Реакция - окисление - металл
Cтраница 2
Изложенное выше раскрывает нам некоторые характерные черты реакции окисления металлов, осуществленной в условиях, относительно близких к равновесию. Перейдем теперь к исследованию поведения металла, подвергающегося действию среды, парциальное давление окислителя в которой ( это слово взято в самом широком смысле) меньше, чем давление диссоциации окисла, сульфида или любого другого соединения, способного образоваться на поверхности металла. [16]
При поверхностной кислородной резке практически все тепло реакции окисления металла концентрируется на обрабатываемой поверхности, тогда как при разделительной резко значительная часть тепла сразу же удаляется из разреза отходящими газами и шлаком. [17]
При поверхностной кислородной резке практически все тепло реакции окисления металла концентрируется на обрабатываемой поверхности, тогда как при разделительной резке значительная часть тепла сразу же удаляется цз разреза отходящими газами и шлаком. [18]
Потребляя Н2, сульфатредуцирующие бактерии способствуют дальнейшему протеканию реакции окисления металла на аноде. В свою очередь, FeS служит катодом, стимулирующим электрохимическую коррозию железа. [19]
Эти виды коррозии существенно различаются как по механизму протекания реакций окисления металла, так и по способам защиты от окисления. [20]
Величины фМе находятся в прямой связи с изобарными потенциалами AG реакций окисления металлов. [21]
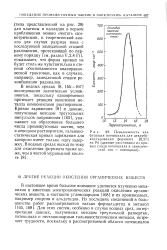 |
Псевдоемкость как функция потенциала для декарбо-ксилирования формиата на РА ( данные рассчитаны из кривых спада потенциала и зависимостей ток - потенциал. [22] |
В водных средах [8, 165-167] исследования значительно усложняются, поскольку одновременно протекает реакция окисления металла компонентами растворителя. Кривые заряжения [8] и данные, полученные методом треугольных импульсов напряжения [165], указывают на образование большего числа промежуточных частиц, чем в неводном растворителе, гальваностатическая кривая заряжения для которого имеет только одну задержку. [23]
Отличны от описанных выше механизмов и процессов электрохимического растворения металла механизм и реакция окисления металлов в результате жизнедеятельности почвенных микроорганизмов - анаэробных и аэробных бактерий. [24]
Позже, в 1789 г., французский химик Лавуазье, изучив некоторые реакции окисления металлов, пришел к тем же выводам, что и Ломоносов, и независимо от него сформулировал этот закон. [25]
Так как величина давления диссоциации окисла изменяется с температурой, то и направление реакции окисления металла также изменяется с температурой. [26]
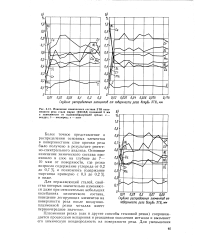 |
Изменение химического состава ЗТВ плазменного реза стали марки 10ХСНД толщиной 8 мм в зависимости от плазмообразующей среды. а - воздух. б - кислород. в - азот. [27] |
Плазменная резка ( как и другие способы тепловой резки) сопровождается процессами испарения и реакциями окисления металла и вызывает его химическую неоднородность на поверхности реза. [28]
При выяснении соответствия материала катода второму требованию сравниваются обратимые окислительно-восстановительные потенциалы и кинетические параметры исследуемой реакции и реакции окисления металла электрода. Стандартные электродные потенциалы реакций электровосстановления рассмотрены выше. [29]
Производное dN / dt в уравнении (2.12) представляет собой изменение количества частиц оксида МаО &, образующегося в реакции окисления металла на единицу поверхности в единицу времени. [30]
Страницы: 1 2 3 4