Реакция - окисление - метанол
Cтраница 2
Серия висмутовых катализаторов ( канадаты, молибдаты, вольфраматы и ниобаты) изучена физическими и химическими методами и испытана в реакции окисления метанола с целью получения дополнительной информации о связи структуры и реакционной способности таких катализаторов. Оказалось, что реакционная способность преимущественно связана с площадью поверхности катализаторов и мало зависит от состава поверхности и объемной структуры. Селективность окисления метанола условным висмутметаллоксидным катализатором существенно не зависит от площади поверхности, состава приповерхностной области и объемной структуры катализатора. Были синтезированы серии модельных висмутметаллоксидных катализаторов путем осаждения оксидов металлов на поверхности подложки из оксида висмута. Модельные эксперименты продемонстрировали, что двумерные поверхностные ме-таллооксидные слои нестабильны на поверхности оксида висмута и при нагревании реагируют с образованием висмутметаллоксидного соединения. Более того, сделан вывод, что такие соединения родственны активным центрам в катализе. Методом КР-спектроскопии получена дополнительная информация о природе активных центров. [16]
Наши данные показывают, что такая же последовательность ( за исключением Се02) наблюдается для каталитической активности этих окислов в реакции окисления метанола. [17]
По данным работы [21], при 20 С в области низких анодных потенциалов на дисперсных электродах имеет место следующее соотношение активности платиновых металлов в реакции окисления метанола: в кислых растворах Pt - Rh Os Ru Pd; в щелочных растворах Pt Rh Os ] Pd - Ru. [18]
Так как, согласно химическому анализу катализаторов, в активной форме катализатор содержал главным образом четырехвалентный ванадий, интересно было исследовать активность четырехокиси ванадия в реакции окисления метанола. [19]
В заключение можно отметить, что термохимические данные по изменению энтальпии при переходе окислов из одной степени окисления в другую могут быть использованы для предсказания их каталитической актив-ности и селективности в реакциях окисления метанола и его гомологов. [21]
В связи с этим в одной из наших работ [6] было высказано предположение, что окислы, каталитически активные в отношении реакции изотопного обмена в молекулярном кислороде, обладают также высокой общей активностью в реакции окисления метанола до формальдегида и двуокиси углерода. [22]
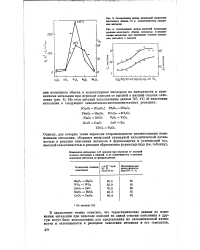
С возрастанием содержания K2S04 происходит увеличение каталитической активности системы в реакции изотопного обмена кислорода. Однако в реакции окисления метанола наблюдается обратный эффект, который, как удалось показать, связан с восстановлением катализатора в ходе реакции. На рис. 2 представлена зависимость между содержанием K2SO4 в катализаторе и количеством кислорода, удаленного из катализатора при воздействии реакционной смеси в течение 6 час при температуре 400 С. [24]
Следует заметить, что на ранее изученных в реакции окисления СО платиновых металлах - Pd, Ru и Os [2-4 ] - также наблюдалась повышенная активность в щелочных электролитах. На ускорение реакции окисления метанола на Pt Ru-электродах в щелочных растворах указывали авторы [13], которые считают, что оно, возможно, связано с изменением природы реагирующей частицы в сильно щелочных растворах. [25]
 |
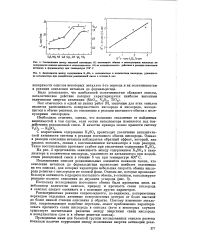
Распределение температуры в реакторе вытеснения с внутренним теплообменом. [26] |
В отличие от реакции окисления метанола и аммиака, в этом процессе угасание реакции протекает легко, если нарушаются условия устойчивости. В случае процессов, протекающих в пламени, обратная теплопроводность осуществляется непосредственно через реагирующую газовую смесь, а не через катализатор. Здесь имеет значение также и обратная диффузия свободных радикалов. Если обратная теплопроводность не достаточно интенсивна, то температура холодного газа, поступающего в реакционную зону, оказывается ниже температуры воспламенения и он выдувает пламя. [27]
В большинстве стран определение метанола основано на реакции получения окрашенного соединения при взаимодействии метанола с фуксиносернистой кислотой. Метод основан на реакции окисления метанола пер-манганатом калия до формальдегида. Количество образовавшегося формальдегида определяют по его реакции с хромотроповой кислотой, в результате которой получается окрашенное соединение. Сравнивая интенсивность окраски полученной реак-дионной смеси с окраской эталона, определяют содержание метанола в испытуемой пробе спирта. [28]
Подробнее всего кинетика и механизм окисления спиртов изучены на окисных катализаторах. Согласно [126], реакция окисления метанола в формальдегид на железо-молибденовом окисном катализаторе протекает по схеме попеременного восстановления - окисления поверхности. [29]
 |
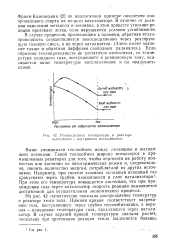
Установка для определения метанола окислительным методом. [30] |
Страницы: 1 2 3