Реакция - окисление - метанол
Cтраница 3
Углекислый газ, находящийся в воздухе помещения, где делают анализ. Вещества, которые в условиях реакции окисления метанола образуют углекислый газ. [31]
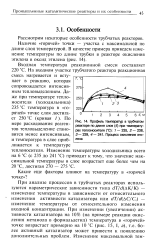 |
Профиль температур в трубчатом реакторе по длине слоя ( в при температурах теплоносителя ( С. 1 - 235, 2 - 238, 3 - 239, 4 - 241. Процесс окисления этилена. [32] |
При анализе процессов в трубчатых реакторах используются параметрические зависимости типа dT / d ( AK / K) - изменение температуры в зависимости от относительного изменения активности катализатора или с / Т / с / ( ДС / С0) - изменение температуры от относительного изменения входной концентрации. При изменении ( увеличении) активности катализатора на 10 % ( на примере реакции окисления метанола в формальдегид) температура в горячей точке возрастает примерно на 10 С ( рис. 15, I, а), т.е. более активный катализатор может привести к появлению дополнительных проблем. [33]
Окисление формальдегида является единственной побочной реакцией. Это позволяет исключить стадию очистки формальдегида от метанола. Реакция окисления метанола имеет порядок по спирту несколько меньший 1, скорость ее не зависит от концентрации СН2О и при мольном отношении кислород / метанол, большем 2, не зависит также от концентрации кислорода. Окисление формальдегида тормозится водой и метанолом, но эти реакции протекают на разных участках поверхности катализатора. Это не вызывает заметного внешнедиффузионного торможения основной реакции получения формальдегида. [34]
На рис. 84 представлены зависимости логарифмов средних значений коэффициентов скоростей от температуры в условиях, при которых вероятно влияние диффузии на скорость реакции. Полученные экспериментальные данные, как видно из рис. 84, хорошо укладываются на прямую. Для реакций окисления метанола и СН20: Е2 - 18 кдж / молъ и EI 792 кдж / молъ, а для реакций дегидрирования тех же продуктов: Е1 48 2 кдж / молъ и Е3 74 2 кдж / молъ. [35]
Энтина [238] объяснили эту особенность поведения рутения сменой лимитирующей стадии процесса при повышении температуры. При 20 С вследствие ранней и прочной адсорбции кислорода на рутении оказывается замедленной хемосорбция метанола. При повышении температуры скорость адсорбции возрастает, появление продуктов адсорбции вызывает изменение свойств поверхности, и при низких потенциалах скорость определяющей становится реакция окисления хемосорбированного метанола. [36]
Как уже упоминалось, свободные иминоксилы могут быть использованы в качестве мягких одноэлектронных окислителей при дегидрировании фенолов и аминов. В некоторых случаях они могут выступать в роли катализаторов цис-транс-изомеризацт и промоторов окислительных реакций. Так, при исследовании изомеризации диметилмалеата в присутствии 2 2 6 6-тетраметилпипе-ридин - 1-оксила и 2 2 6 6-тетраметил - 4-оксипиперидин - 1-оксила оказалось, что в реакции они не расходовались, а скорость изомеризации сильно увеличивалась. По-видимому, катализ осуществляется посредством образования переходного молекулярно-ра-дикального комплекса, в котором неспаренный электрон делока-лизуется на диметилмалеат. Примером промо-тирования окислительных процессов может служить реакция окисления метанола. Недавно было установлено [15,16], что эту реакцию промотирует и ди-тоет-бутилиминоксил. Стабильный радикал при этом регенерируется, и скорость этой реакции пропорциональна концентрации иминоксила. При иной стехиометрии компонентов комплекса скорость реакции уменьшается. [37]
Страницы: 1 2 3