Реакция - окисление - пропан
Cтраница 2
Таким образом, могут получаться нормальные и изопро-пилгидроперекиси. При комнатной температуре единственным продуктом реакции окисления пропана, по данным А. Б. Нал-бандяна и Н. В. Фок [11], является гидроперекись пропила; альдегиды и другие продукты ими не обнаружены. [16]
Мы считали, что детальное кинетическое изучение эффективного действия бромистого водорода представляет общехимический интерес и позволит со временем правильно оцепить практические перспективы этой отрасли катализа. С этой целью нами были рассмотрены кинетические закономерности реакции окисления пропана, катализируемой бромистым водородом. Как ужо указывалось, главным продуктом реакции окисления пропана в присутствии бромистого водорода является ацетон. [17]
При наличии двух макроскопических стадий, каждая из которых имеет свое значение теплового эффекта и свою область максимальной скорости, суммарная зависимость аТ от времени изображается кривой с двумя налагающимися друг на яруга максимумами. Для иллюстрации на рис. 101 приведена кривая разогрева в реакции окисления пропана в присутствии НВг, которая, как указывалось, состоит из двух макроскопических стадий. [18]
Решающую роль играет начальная стадия, которая обусловливает особенности дальнейшего развития процесса. Разделяющиеся во времени макроскопические стадии были открыты и изучены в реакции окисления пропана с бромистым водородом в качестве катализатора. Было установлено, что вначале протекает быстро заканчивающаяся инициирующая реакция, в результате которой образуется промежуточный продукт. Этот продукт распадается в ходе реакции с образованием свободных радикалов, инициируя вторую стадию - окисление пропана в ацетон. Макроскопические стадии наблюдаются и в жидкофазном окислении углеводородов с катализаторами переменной валентности. Цысковский и Киселева [28] обратили внимание на то, что при окислении керосина с нафтенатом марганца катализатор находится в растворенном состоянии и инициирует реакцию только в начале окисления. Затем он полностью выпадает в осадок и не принимает участия в реакции. В работе Кнорре, Майзус и Эмануэля [29] была изучена кинетика окисления н-декана со стеаратами кобальта и марганца. Было установлено, что катализатор претерпевает вначале валентные превращения, а затем выпадает в осадок и не принимает заметного участия в окислении. Таким образом, катализированное окисление углеводородов часто протекает в две стадии: в первой катализатор находится в растворе и, инициируя цепи, ускоряет окисление; во второй он находится в осадке и не принимает участия в инициировании цепей. Такое резкое разделение реакции на две стадии имеет место не всегда. [19]
Из этих данных ясно, что уксусный альдегид является единственным веществом, обусловливающим в искусственной смеси возникновение реакции с того уровня, на котором она была прервана в соответствующей частично прореагировавшей реальной смеси пропана с кислородом. А так как выше уже было показано, что возобновление реакции окисления пропана с уровня, на котором она была остановлена, есть следствие сохранения в ней активного стабильного промежуточного продукта, способного давать вырожденные разветвления, то, следовательно, результаты приведенных опытов однозначно показывают, что этим продуктом является уксусный альдегид. [20]
Как видно из представленных результатов, температурные области эффективного действия катализаторов для выбранных реакций достаточно разнесены. В температурном диапазоне 220 - 260 С, где достигается выход серы близкий к 100 %, реакция окисления пропана протекает с незначительной скоростью. [21]
Пытаясь найти причину этого явления, Н. М. Эмануэль предпринял тщательное изучение того, что происходит с системой в первые десятки секунд. Эта быстро заканчивающаяся реакция, не приводящая к сколько-нибудь заметному превращению пропана, оказывает, однако, значительное действие на все последующие стадий реакции окисления пропана. Ацетон, подмешанный к смеси, тормозит и при предельной концентрации полностью затормаживает именно эту начальную реакцию, но не оказывает никакого действия на последующую основную реакцию получения ацетона. Это объяснило результат опытов с примесью ацетона, но не сняло вопроса о том, почему же начальная реакция является целиком определяющей для всего последующего процесса. [22]
Термическое окисление углеводородов идет так же, как и фотохимическое, при помощи свободных радикалов. Обнаружить непосредственно эти свободные радикалы в реакциях медленного окисления очень трудно и только недавно В. В. Воеводскому и А. И. Поройковой удалось, изучая изотопный обмен с дейтерием в ходе реакции окисления пропана, впервые подойти к решению этого вопроса. Однако вся сумма известных фактов не оставляет сомнения в правильности этого утверждения. Действительно, искусственное создание в способной к окислению системе свободных радикалов при помощи света, примеси перекиси, гексафенилэтана, ионов переменной валентности вызывает процесс окисления углеводородов, альдегидов и других органических веществ. [23]
Такое сходство в поведении анализируемой перекиси с диоксиметил-перекисью приводит авторов к окончательному выводу о том, что последняя является единственной органической перекисью, содержащейся в незначительных количествах в продуктах окисления пропана. Так как эта перекись легко образуется в растворе конденсацией формальдегида с перекисью водорода [101] и так как выше 190 она подвергается распаду 1102 ], то естественнее всего предположить, что в зоне реакции окисления пропана возникает только перекись водорода, а диоксиметилперекись образуется взаимодействием перекиси водорода с формальдегидом после выпуска продуктов из реакционного сосуда. [24]
Мы считали, что детальное кинетическое изучение эффективного действия бромистого водорода представляет общехимический интерес и позволит со временем правильно оцепить практические перспективы этой отрасли катализа. С этой целью нами были рассмотрены кинетические закономерности реакции окисления пропана, катализируемой бромистым водородом. Как ужо указывалось, главным продуктом реакции окисления пропана в присутствии бромистого водорода является ацетон. [25]
Ход процесса удобно контролировать по значительному изменению ( увеличению) давления. Давление возрастает во времени но кривой автокаталитического типа, что при доказанном отсутствии каталитического действия конечных продуктов указывает на цепной механизм реакции, включающий: разветвление цепей. На рис. 1 показана типичная кинетическая кривая реакции окисления пропана молекулярным кислородом. [26]
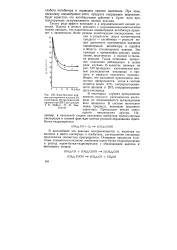 |
Кинетические кривые расходования пропана ( / и кислорода ( 2 при окислении пропана при 200 С ( по данным 3. К. Майзус, Н. М. Эмануэля. [27] |
Это приведет к чрезвычайно резкому замедлению, практически к полной остановке реакции. В качестве примера на рис. 100 приведены кинетические кривые расходования кислорода и пропана в реакции окисления пропана. [28]
Такого рода эффект возможен и в неразветвленной цепной реакции. Это приведет к чрезвычайно резкому замедлению, практически к полной остановке реакции. В качестве примера на рис. 97 приведены кинетические кривые расходования кислорода и пропана в реакции окисления пропана. Видно, что окисление практически полностью прекращается, когда в системе остается около 33 % непрореагировавшего пропана и 28 % непрореагировавшего кислорода. [29]
По его мнению, в первый десяток секунд идет какая-то, пока неизвестная, быстрая цепная разветвленная реакция между НВг, пропаном и кислородом. Эта реакция быстро затормаживается. Именно, она замедляется, а в предельном случае - полностью подавляется примесью ацетона. В этой реакции образуются некоторые активные частицы, которые медленно ( по мономолекулярному закону) распадаются на свободные радикалы. Каждый из последних дает цепочку из v звеньев реакции окисления пропана. Таким образом, кинетика основной реакции отражает скорость распада активных частиц ( по мономолекулярному закону), зародившихся в довольно большом количестве / в начальной разветвленной реакции. [30]
Страницы: 1 2 3