Реакция - окисление - изопропилового спирт
Cтраница 2
Изучение влияния органических продуктов реакции окисления изопропилового спирта - ацетона и уксусной кислоты на эту реакцию показало, что ацетон на скорость процесса и на выход перекиси водорода не влияет. Уксусная же кислота, не влияя на выход перекиси водорода, оказывает тормозящее действие на процесс окисления изопропилового спирта. При содержании уксусной кислоты в исходном спирте - 3 0 % реакция окисления при 115 протекает примерно вдвое медленнее, чем в отсутствие уксусной кислоты. [16]
Методом ингибирования исследован механизм реакции окисления изопропилового спирта и подтвержден радикально-цепной характер этой реакции. [17]
Разработка полярографического метода определения продуктов реакции окисления изопропилового спирта с целью автоматизации процесса, Отч. [18]
К числу неизученных вопросов механизма реакции окисления изопропилового спирта прежде всего следует отнести механизм образования самих перекисных соединений. [19]
Процесс получения перекиси водорода основан на реакции окисления изопропилового спирта кислородсодержащим газом в жидкой фазе в четыре стадии. Установка отличается простотой аппаратурного оформления, удобством обслуживания. [20]
 |
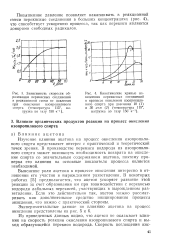
Зависимость скорости окисления изопропилового спирта и ее анаморфоза в полулогарифмических координатах. [21] |
Как видно из приведенных данных, реакция окисления изопропилового спирта имеет высокий температурный коэффициент, равный приблизительно двум. [22]
На основании полученных данных может быть предложена следующая схема механизма реакции окисления изопропилового спирта. [23]
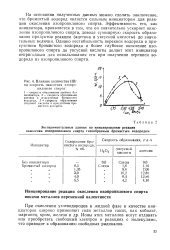
Из приведенных данных видно, что ацетон не оказывает влияния на скорость реакции окисления изопропилового спирта и выход образующейся перекиси водорода. [25]
В присутствии изопропилмеркаптана не происходит полного подавления активности р-фталоцианина меди, ускоряющего реакцию окисления изопропилового спирта в ацетон при 350 С. [26]
Позже эти исследования были развиты в работах Денисова и Соляникова [7-9], изучавших реакцию окисления изопропилового спирта при температуре 99 5 - 130 и давлении 10 - 15 атм. Ими рассмотрены элементарные стадии процесса окисления изопропилового спирта, в частности реакции зарождения цепи, и определено отношение константы скорости продолжения цепи к корню квадратному из константы скорости обрыва цепей. [27]
На основании полученных данных можно сделать заключение, что бромистый водород является сильным инициатором для реакции окисления изопропилового спирта. Эффективность его, как инициатора, проявляется в том, что он значительно ускоряет окисление изопропилового спирта, доводя суммарную скорость образования продуктов реакции ( ацетона и уксусной кислоты) до значительных величин. Однако нестабильность перекиси водорода в присутствии бромистого водорода и более глубокое окисление изопропилового спирта до уксусной кислоты делает этот инициатор непригодным для использования его при получении перекиси водорода из изопропилового спирта. [29]
Из табл. 4 видно, что С14 ( р-излучение) оказывает заметное инициирующее действие на реакцию окисления изопропилового спирта. Необходимо отметить, что при этом выход перекиси водорода относительно высок, что свидетельствует о стабильности перекиси водорода в неводных средах при воздействии р-активности. [30]
Страницы: 1 2 3