Реакция - окисление - водород
Cтраница 3
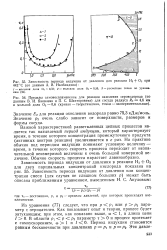
Схематически развитие реакции окисления водорода изображено на рис. 1.7. Стрелки показывают, в какие реакции [ вступают частицы, участвующие в реакции. Внутри полуострова воспламенения достаточно одного атома водорода, чтобы вызвать появление лавины активных частиц, образование которых прекращается лишь по израсходовании исходных веществ. [31]
В наиболее хорошо изученной разветвленно-цепной реакции окисления водорода разветвления осуществляются с участием атомарного водорода. [32]
Значение Е2 для реакции окисления водорода равно 75 3 кДж / моль. Значение р2 очень слабо зависит от поверхности, размеров и формы сосуда. [34]
Например, для реакции окисления водорода при невысоких давлениях обрыв цепей происходит преимущественно на атомах Н, которые присутствуют в наибольшей концентрации. [35]
Продолжение цепи в реакции окисления водорода непосредственно после ее зарождения осуществиться не может, так как радикал НС2 малоактивен. Этой стадии предшествует стадия разветвления цепи. [36]
Наиболее активными катализаторами реакции окисления водорода являются платина и иридий, которые ускоряют процесс уже при температуре - 195 С. Эти металлы в рассматриваемой реакции однотипны с другими переходными металлами. [37]
Ведущая кинетическая цепь реакции окисления водорода кислородом отвечает элементарным реакциям ( 1) - ( 3), которые протекают с участием атомов и радикалов и образуют единую разветвленную цепь. Однако в водородно-кислородных пламенах по мере прохождения этих реакций все более важную роль начинают играть и другие стадии пламенного процесса, и когда реакции ( 1) - ( 3) становятся существенно обратимыми или генерируемые ими активные частицы гибнут в конкурирующих реакциях, разветвление цепи прекращается. Таким образом, в пламени ( в отличие от фронта детонации) имеет место динамическое равновесие, и значительная доля энтальпий горения аккумулируется в радикалах и атомах, присутствующих в пламени в высоких концентрациях. [38]
Примером здесь может служить реакция окисления водорода ( см. стр. [39]
Рассмотрим в качестве примера реакцию окисления водорода кислородом, для которой при получении Н2О ( ж) Д6 298 - 56 7 ккал и АЯ 298 - 68 3 ккал. [40]
Такое определение было проведено для реакции окисления водорода. [41]
Аналогичным образом следы влаги инициируют реакции окисления водорода или окиси углерода кислородом. [42]
Поэтому в этих условиях протекает реакция окисления водорода, а не германия. [43]
Такое определение было проведено для реакции окисления водорода. [44]
В подавляющем большинстве опубликованных исследований реакция окисления водорода изучалась в качестве модельной, позволяющей в наиболее чистом виде выявлять основные закономерности окислительного катализа, не осложненные проблемой избирательности. В последнее время реакция каталитического окисления водорода начинает приобретать и практическое значение как источник энергии. [45]
Страницы: 1 2 3 4