Реакция - окисление - двуокись - сера
Cтраница 1
Реакция окисления двуокиси серы - гетерогенно-каталитиче-ская, и это выражение представляет собой квазигомогенную кинетическую зависимость, описывающую экспериментальные данные для катализатора стандартного состава, с зернами определенного размера и формы. [1]
Реакция окисления двуокиси серы в присутствии пятиокиси ванадия начинает протекать уже при сравнительно невысоких температурах2, что выгодно отличает этот катализатор от других неплатиновых катализаторов и дает возможность достигать достаточно полного превращения. [2]
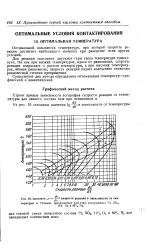 |
Значения х - - L скорости реакции в зависимости от температуры и степени превращения для газа, содержащего 7 SCh 11 % О2 и 82 % Nj. [3] |
Для реакции окисления двуокиси серы такая температура существует, так как при низких температурах, вдали от равновесия, скорость реакции возрастает с ростом температуры, а при высоких температурах, вблизи-равновесия, скорость реакции падает вследствие снижения равновесной степени превращения. [4]
Поскольку реакция окисления двуокиси серы связана с изменением числа молекул, численное значение константы равновесия зависит от того, в каких единицах выражается состав газовой смеси. [5]
Ускорение реакции окисления двуокиси серы под влиянием окислов азота является одним из первых получивших известность примеров каталитического действия. [6]
Скорость реакции окисления двуокиси серы зависит от температуры, активности катализатора и концентрации реагирующих веществ. Возрастанию скорости реакции, но затрата энергии на сжатие газа экономически не оправдывается повышением выхода. [7]
Большая скорость реакции окисления двуокиси серы на промышленных ванадиевых катализаторах заставляет предполагать, что при протекании этого процесса концентрации реагирующих веществ и продукта реакции, а также температура в газовом потоке, у наружной поверхности и в глубине зерен катализатора могут быть неодинаковыми. Это означает, что скорость контактного процесса может существенным образом зависеть от скорости переноса веществ и тепла внутри системы. [8]
Кажущаяся молекулярность реакции окисления двуокиси серы на ванадиевых катализаторах, как показано на стр. [9]
Большая скорость реакции окисления двуокиси серы на промышленных ванадиевых катализаторах заставляет предполагать, что при протекании этого процесса концентрации реагирующих веществ и продукта реакции, а также температура в газовом потоке, у наружной поверхности и в глубине зерен катализатора могут быть неодинаковыми. Это означает, что скорость контактного процесса может существенным образом зависеть от скорости переноса веществ и тепла внутри системы. [10]
 |
Оптимальные температуры окисления двуокиси серы на ванадиевых и платиновых.| Зависимость разности между равновесной и оптимальной температурами от равновесной температуры. [11] |
Кажущаяся молекулярность реакции окисления двуокиси серы на ванадиевых катализаторах, как показано на стр. [12]
Каталитическое действие окиси железа при реакции окисления двуокиси серы известно уже более 100 лет. [13]
Метод основан на увеличении скорости реакции окисления двуокиси серы при больших степенях превращения за счет выделения образующейся трехокиси серы в промежуточном абсорбере с последующим доокислением непрореагировавшей двуокиси серы. [14]
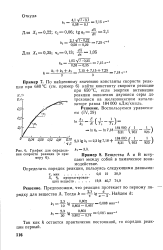 |
График для определе-ния скорости реакции ( к при. [15] |
Страницы: 1 2 3