Реакция - отщепление - водород
Cтраница 2
Гидроароматические спирты не способны так легко дегидрироваться в ядре. Реакция отщепления водорода в этом случае идет, главным образом, у гидроксильной группы, в результате образуются соответствующие гидроароматические кетоны, например: дегидрогенизация сабинола при 280 приводит почти количественно к туйону. Из ментола или неоментола образуется, главным образом, ментон и небольшое количество тимола. [16]
Эти цепные реакции состоят из двух частей: отщепления водорода и стабилизации радикалов, образовавшихся после отщепления водорода. В частности, реакции отщепления водорода влияют на окончательный состав продукта пиролиза. В результате рекомбинации радикалов происходит обрыв цепи и цепные реакции прекращаются. [17]
Скорость отщепления водорода можно увеличить, добавляя соответствующий катализатор, лучше всего фермент - де-гидрогеназу. Роль катализатора в реакции отщепления водорода может выполнять и сам металл электрода, например, платинированная платина. Однако эффект будет значительно меньше, чем при применении ферментов. Скорость ионизации водорода также можно увеличить, применяя электрод, обладающий каталитическими свойствами - платинированную платину или палладий. Такие электроды, однако, катализируют и побочные реакции, в частности, реакцию окисления водорода кислородом, и поэтому не всегда применимы. [18]
Он отметил, что для реакций отщепления водорода кетонами и а-расщепления возбужденное состояние приводит непосредственно к образованию первоначально наблюдаемых продуктов ( бирадикалов) без понижения энергии электронов, но не сумел изобразить последовательность поверхностей потенциальной энергии реагента и продукта. [19]
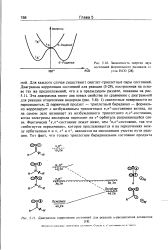 |
Зависимость энергии двух. [20] |
Для каждого случая существуют синглет-триплетные пары состояний. Диаграмма корреляции состояний для реакции ( 5 - 29), построенная на основе тех же предположений, что и в предыдущем разделе, показана на рис. 5.11. Эта диаграмма имеет два новых свойства по сравнению с диаграммой для реакции отщепления водорода ( рис. 5.8): 1) синглетные поверхности не пересекаются; 2) первичный продукт - триплетный бирадикал - формально коррелирует с возбужденным триплетным я - 7г - состоянием кетона, но на самом деле возникает из возбужденного триплетного л а - состояния, когда электроны кислорода переходят на а - орбиталь разрывающейся связи. Фактически Зтг тг - состояние лежит ниже, чем Зл ( г - состояние, так что избегнутое пересечение, которое прослеживается и на пересечениях между орбиталями / 1И1г сг и1г, находится на нисходящем участке пути реакции. [21]
Основная проблема, от решения которой зависит получение хороших выходов многих ценных продуктов частичного окисления, заключается в том, чтобы создать условия, при которых деструкция их в результате разложения или окисления происходила бы со скоростью, сравнимой со скоростью окисления углеводорода, из которого они образуются. Можно произвести грубое сравнение стабильности, если предположить, что начальная стадия разложения или окисления молекулы кислородного соединения или молекулы углеводорода заключается в отщеплении атома водорода свободным радикалом или молекулой кислорода. Скорость реакции отщепления водорода радикалами метила изучалась интенсивно Стици и сто школой. В табл. 9 приводятся значения энергии активации для реакций отщепления водорода от некоторых обычных углеводородов и кислородных соединений и отношения константы скорости рекомбинации радикала метила при 182 С. [22]
Формулы ( 17) и ( 12) отличаются только первыми слагаемыми в числителе и знаменателе. Для того, чтобы измерить окислительный потенциал в слабых системах, необходимо, чтобы kt, kt, kf, k & были достаточно велики. Скорость реакции отщепления водорода можно увеличить, добавляя соответствующий катализатор, лучше всего фермент дегидрогеназу. Однако роль катализатора в реакции отщепления водорода может выполнять и сам металл электрода, например платинированная платина. Скорость ионизации водорода можно увеличить, применяя электрод, обладающий каталитическими свойствами, - платинированную платину или палладий. Такие электроды, однако, катализируют и побочные реакции. Поэтому в качестве катализаторов электродной реакции чаще применяют сильные окислительно-восстановительные системы ( мети-леновая синь, ионы церия и др.), добавляемые в столь малых количествах, чтобы концентрации окисленной и восстановленной форм изучаемой системы практически оставались неизменными. [23]
Дегндрогеназы - ферменты, отщепляющие атомы водорода или электроны от органических субстратов и переносящие их на какой-либо акцептор, кроме кислорода. Акцепторами электронов в цепи окислительно-восстановительных реакций, катализируемых дегндрогеназами, являются никотннамидные и флавиновые коферменты. Если фермент катализирует реакцию отщепления водорода непосредственно от окисляемого вещества ( первичного субстрата), то его называют первичной д е г и д - рогеназой. [24]
Существует соответствие между эффективностью этих окислов как А. MgO, способствуют реакциям отщепления водорода от макромолекул каучука, что приводит к образованию большего числа поперечных связей. [26]
Сырой материал исследовали методом аналитической хроматографии; были обнаружены два неизвестных и три новых соединения. Для каждого из этих соединений характерна реакция отщепления водорода и фтора от соседних углеродных атомов с образованием олефинов. [27]
Для углеводородов фактором, в сильной мере определяющим их ре-акционноспособиость, является наличие дпойпых связей С С. Изучение кинетики одной и той жо реакции: различных углеводородов, отличающихся между собой наличием или отсутствием двойной связи, должно дать некоторые количественные характеристики влияния последней на реакционноспособность этих углеводородов. Разносторонний интерес с этой точки зрения представляет реакция отщепления водорода от молекул парафиновых н олефиповых углеводородов, сопровождающаяся образованием двойной связи. [28]
Почти все применяемые в промышленности мономеры поглощают свет лишь в области длин волн менее 320 нм. Поскольку доступные в настоящее время источники света излучают преимущественно в области длин волн более 320 нм, непосредственная фотохимическая полимеризация мономеров в промышленности невозможна. Поэтому применяют фотоинициаторы [10], которые поглощают свет, а затем за счет реакций отщепления водорода или расщепления образуют первичные радикалы R и, тем самым, инициируют полимеризацию. Дальнейшие процессы совершенно аналогичны тем, которые протекают при обычной ( термической) полимеризации. [29]
Обнаруженное явление оказалось широко распространенным в природе и в различных технических системах. Но почему, например, окрашенная фотоэмульсия вдруг делается чувствительной к красному и инфракрасному свету, хотя известно, что для реакции разложения галоидного серебра, входящего в ее состав, необходим свет с меньшей длиной волны и большей энергией кванта. Почему под действием красного света, поглощаемого хлорофилловыми пигментами, в зеленых листьях протекает реакция фотохимического отщепления водорода от воды и присоединения его к углекислоте. Ведь фотосинтез требует энергии в 3 - 4 раза большей, чем та, которую несут кванты красного света. [30]
Страницы: 1 2 3