Реакция - переход
Cтраница 2
При исследовании реакции перехода солей кобальта в карбо-нилы в присутствии окиси углерода и водорода ( также катализируемой карбонилами кобальта) нами была отмечена аналогичная зависимость. [16]
Напишите уравнения реакций перехода исходного комплекса в диакватетрахлоро - ( П) кобальтат водорода и обратно. Какую дополнительную функцию выполняет в этом процессе концентрированная соляная кислота. [17]
Напишите уравнения реакций перехода исходного комплекса в диакватетрахлорокобальт ( П) водорода и обратно. Какую дополнительную функцию выполняет в этом процессе концентрированная соляная кислота. [18]
При исследовании реакции перехода солей кобальта в карбо-нилы в присутствии окиси углерода и водорода ( также катализируемой карбонилами кобальта) нами была отмечена аналогичная зависимость. [19]
Возможными путями реакции перехода гидратированных ионов в кристаллическую решетку металла являются следующие: 1) ионы переносятся из полностью гидратирован-ного состояния в растворе к элементу плоскости электродной поверхности и затем мигрируют в частично дегидратированном состоянии к местам роста, в особенности к граням и углам, где они внедряются в решетку, полностью теряя при этом гидратную воду. Скорость определяющей стадией может быть или перенос ионов из их адсорбированного полностью гидратированного положения в гельмгольцевском двойном слое к плоской части поверхности, диффузия к месту роста, или внедрение в решетку; 2) после попадания в гельмгольцевскую часть двойного слоя гидрати-рованный ион мигрирует в гельмгольцевском слое к месту роста, в котором он разряжается и внедряется непосредственно в решетку. [20]
Рассмотрим теперь реакцию перехода атома водорода, которая осуществляется при многих реакциях передачи цепи. [21]
Когда, кроме реакции перехода, все остальные стадии электродной реакции протекают легко, выявляется в чистом виде перенапряжение перехода. [22]
При составлении уравнения реакций перехода подобного типа необходимо знать среду ( кислотную или щелочную), в которой осуществляется такой переход. Рассмотрим на примере превращения СгС42 - и С О. [23]
Когда стехиометрические коэффициенты реакции перехода окисленной формы в восстановленную не равны единице, они входят в уравнение как показатели степеней соответствующих концентраций. При участии ионов водорода в реакции окисленная форма переходит в восстановленную с изменением состава иона окислителя или иона восстановителя. Электродный потенциал в этом случае зависит также и от концентрации ионов водорода. [24]
Тем самым для каждой реакции перехода получается один и тот нее равновесный потенциал е0, вследствие чего из измерений этого потенциала нельзя ничего сказать о механизме реакция. [25]
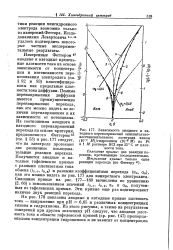 |
Зависимость анодного и катодного перенапряжений окислительно-восстановительного электрода хинон ( Ю-3 М / гидрохинон ( Ю-2 М на Pt в 1 М растворе НС1 при 25 С от плотности тока. [26] |
Сплошные кривые: две реакции перехода, протекающие последовательно. [27]
Чисто теоретический подход к реакциям перехода атома водорода основан на вычислении разности энергий сопряжения в переходном и начальном состояниях. В случае реакции перехода атома водорода происходит взаимодействие я-электрона радикала с a - электроном связи С - Н, поэтому кажется, что здесь не может быть применено я-электронное приближение. Однако Базилевский [31, 32] показал, что я-электронное приближение может быть применено и для этих реакций. [28]
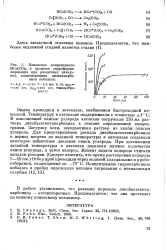 |
Изменение концентрации НСо ( СО4 в процессе гидроформи-лирования при различных начальных концентрациях диоктакарбо-нила кобальта. [29] |
В работе установлено, что реакция перехода дикобальтоктакарбонила - автоускоренная. Предполагается, что она протекает по цепному коненсному механизму. [30]
Страницы: 1 2 3 4