Реакция - разложение
Cтраница 3
Реакции разложения, при которых из молекул одного вещества образуются молекулы нескольких веществ. [31]
Реакция разложения N2O4 протекает с изменением количества молекул по уравнению М2О4 21ЧО2, что позволяет определить степень термической диссоциации и константу равновесия при различных температурах по измерениям давления и объема реакционной смеси. [32]
Реакции разложения - химические реакции, в результате которых из одного вещества образуется несколько новых веществ. [33]
Реакции разложения C3S или С3А при нормальной температуре характеризуются уменьшением энергии Гиббса, однако практически эти реакции не протекают и системы находятся в состоянии покоя. Изучить метастабильное равновесие экспериментально не всегда возможно, поскольку реакция может не остановиться на промежуточной стадии. В этом случае кинетические факторы являются определяющими. [34]
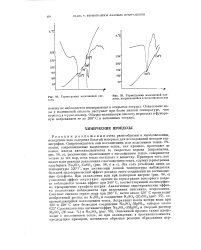 |
Термограмма малеиновой кислоты.| Термограмма малеиновой кислоты, нагревавшейся в запаянном сосуде. [35] |
Реакции разложения очень разнообразны и многочисленны, вследствие чего содержат богатый материал для исследований методом термографии. Сопровождаются они поглощением или выделением тепла. Реакции, сопровождаемые выделением тепла, как правило, протекают до конца, иногда автокаталитически со скоростью взрыва ( пироксилин, рис. 96, а); разложение, протекающее с поглощением тепла, совершается только до тех пор, пока тепло поступает к веществу. Эта соль устойчива лишь до температуры 520 С; при достижении данной температуры наблюдается большой эндотермический эффект распада этого соединения на составляющие сульфаты. При охлаждении или при повторном нагреве ( рис. 96, в) указанный эффект отсутствует, причем на термограмме повторного нагрева наблюдается только эффект при 240 С, соответствующий полиморфному превращению сульфата натрия. Аналогичные эндотермические эффекты разложения наблюдаются при нагревании сингенита, астраханита. Сингенит сначала теряет воду при 265 С, затем около 450 С происходит необратимый распад на K2S04 и соединение K2S04 - 2CaS04 ( рис. 97), сопровождающийся поглощением тепла. Астраханит после потери воды при 120 и 220 С дает безводное соединение Na2S04 - MgS04, которое около 625 С распадается на антивантгоффит Na2S04 3MgS04 и твердый раствор MgS04 ( 30 мол. [36]
Реакции разложения, даже если они эндотермичны и требуют затраты энергии, обычно протекают без затруднений; когда часть образующихся продуктов будет в газообразном или жидком состоянии, а часть в твердом, можно непосредственно получить новые вещества в чистом состоянии. [37]
Реакции разложения порошком олова двойных солей галогенидов ди-фенилбромония ( соответственно хлорония) и хлорного олова проводят в тех же условиях. [38]
Реакция разложения проходит быстрее в растворе диоксана по сравнению с тетра-гидрофураном ( см. соединения. Нарушение расположения констант связано, по-видимому, с различной полярностью растворителя. Константы относятся к 30 С, за исключением отмеченных звездочками, температуры которых даны в примечании. [39]
Реакции разложения - реакции, при которых из одного сложного вещества образуется несколько веществ. [40]
Реакция разложения - из одного сложного вещества образуется несколько менее сложных: ABC АВ С. [41]
Реакции разложения - реакции, при которых из одного сложного вещества образуется несколько веществ. [42]
Реакции разложения и уплотнения являются важнейшими превращениями, наблюдаемыми при крекинг-процессе. [43]
Реакция разложения в водном растворе происходит тогда, когда образуются непрочные, разлагающиеся вещества. [44]
Реакции разложения обычно протекают при нагревании веществ и являются эндотермическими реакциями. Как и реакции соединения, реакции разложения могут протекать с изменением и без изменения степеней окисления элементов. [45]
Страницы: 1 2 3 4