Реакция - разложение - вода
Cтраница 2
Потенциал быстро достигает некоторого значения, характерного для данной электрохимической реакции, затем медленно увеличивается и, наконец, в момент времени, близкий т, скачкообразно поднимается до значения, соответствующего протеканию электро-химической реакции при более отрицательном потенциале, например реакции разложения воды с выделением газообразного водорода. [16]
Микробиологическими исследованиями последнего времени [17] установлено нахождение в водах и породах целого ряда нефтяных месторождений, притом на громадных глубинах ( до 1000 м), анаэробной нефтяной микрофлоры, которая, возбуждая некоторые специальные виды брожения, вызывает распад продуктов животного и растительного происхождения с выделением горючих газов: метана, водорода и др. Среди этих биохимических процессов особый интерес представляют: метановое и водородное брожение белков, метановое брожение клетчатки и др. Таким образом, не исключена возможность, что источником водорода для процессов гидрогенизации, протекающих в природе, являются не пирогене-тические реакции разложения воды, а процессы бактериального характера. [17]
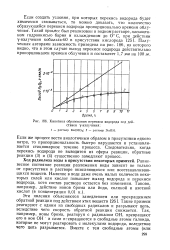 |
Кинетика образования перекиси водорода под действием у-изл Учения. [18] |
Равновесное состояние реакции разложения воды зависит не только от присутствия в растворе окисляющихся или восстанавливающихся веществ. Наличие в воде даже очень малых количеств некоторых солей или кислот повышает выход водорода и перекиси водорода, хотя состав раствора остается без изменения. [19]
Проводят электролиз раствора - NaOH заданной концентрации. В приборе идет реакция разложения воды. [20]
В случае а-частиц должна возникнуть значительно более высокая концентрация продуктов, для того чтобы скорости прямой и обратной реакций сравнялись между собой. Было обнаружено, что равновесное состояние в реакции разложения воды сильно зависит от присутствия примесей. [21]
При электролизе ток, пропускаемый через электролизер, может расходоваться на несколько параллельных электрохимических реакций. Например, при электролизе водных растворов основным реакциям сопутствует реакция разложения воды на кислород и водород, выделяющиеся соответственно на аноде и катоде. [22]
 |
Электролитическое разложение воды. [23] |
Как показано на рис. 3 - 3, реакция, приводящая к образованию воды, противоположна реакции разложения воды. Эти химические превращения подчиняются простым правилам. В левой части рисунка мы видим два атома кислорода - справа также находятся два атома кислорода. Слева мы видим четыре атома водорода - столько же атомов водорода имеется в правой части рисунка. Мы видим, что атомы не исчезают и не появляются. При химических реакциях число атомов остается постоянным. Если образуются две молекулы Н2О, то расходуется четыре атома водорода. Запомните, что при химических реакциях число атомов остается постоянным. [24]
Если в системе происходит реакция 2Н2 - f - Oa 2Н2О ( например, рассматривается реакция соединения водорода и кислорода), то система в состоянии равновесия является двухкомпонентной, так как в этом случае любой заданный состав системы может быть образован двумя веществами с помощью уравнения реакции. Если, наконец, в системе с реагирующими веществами количества веществ точно соответствуют стехиометрии реакции ( например, рассматривается реакция разложения воды), то такая система будет одноком-понентной, так как теперь, кроме уравнения реакции, имеется еще соотношение между веществами в системе. Это является дополнительным условием ( уравнением), связывающим количества веществ в системе, и поэтому любой возможный в этом случае состав системы может быть образован одним веществом с помощью уравнения реакции и соотношения между количествами веществ. [25]
Прежде всего необходимо отметить, что электрохимическим путем можно проводить и такие реакции, которые химическим путем при обычной температуре не идут. Самопроизвольные реакции всегда сопровождаются уменьшением свободной энергии; электрохимическим же путем можно проводить реакции, сопровождающиеся увеличением свободной энергии. Например, реакция разложения воды при обычной температуре не идет, но процесс соединения водорода с кислородом в присутствии катализатора протекает легко. Электрохимическим путем ( электролизом) вода легко разлагается уже при обычной температуре. [26]
Прежде всего необходимо отметить, что электрохимическим путем можно проводить и такие реакции, которые химическим путем при обычной температуре не идут. Самопроизвольные реакции всегда сопровождаются уменьшением свободной энергии; электрохимическим же путем можно проводить реакции, сопровождающиеся увеличением свободной энергии. Например, реакция разложения воды при обычной температуре не идет, но процесс соединения водорода с кислородом в присутствии катализатора протекает легко. Электрохимическим же путем ( электролизом) вода легко разлагается уже при обычной температуре. [27]
Проводят электролиз раствора щелочи заданной концентрации. В приборе идет реакция разложения воды. [28]
Цезий и рубидий очень похожи по своим свойствам, а в химическом отношении они похожи на калий и являются самыми активными из всех стабильных элементов, встречающихся в природе в виде тех или иных соединений. На воздухе при комнатной температуре они настолько активно взаимодействуют с кислородом, что мгновенно вспыхивают. Очень активно взаимодействуют эти металлы и с водой. Реакция разложения воды протекает с большой скоростью и сопровождается воспламенением. Цезий реагирует со льдом при любой температуре выше - 116 С; он активно взаимодействует также с азотом. Высокую активность цезия и рубидия с кислородом и азотом используют при изготовлении радиоламп для создания в них высокого вакуума. [29]
Рассмотренные нами особенности окислительно-восстановительных реакций, а также приведенные в табл. 3 Приложения потенциалы относятся к процессам, протекающим в водных растворах. Но вода, как реакционная среда, сама обладает окислительно-восстановительными свойствами. Например, фтор - сильнейший из известных окислителей, нельзя применять в водных растворах, так как он взаимодействует с водой с выделением кислорода, а такие сильные восстановители, как щелочные металлы, выделяют из воды водород. Однако такие реакции разложения воды практически протекают настолько медленно, что их приходится учитывать только при длительном хранении водных растворов окислителей или восстановителей. Медленность протекания некоторых окислительно-восстановительных реакций - причина того, что в отдельных случаях практически не происходит взаимодействия между веществами с большой разностью окислительно-восстановительных потенциалов. [30]
Страницы: 1 2 3