Реакция - разложение - гидроперекись
Cтраница 1
Реакция разложения гидроперекиси сильно экзотермична - съем тепла ведется через рубашку реактора, кроме того, реакционный раствор непрерывно прокачивается через выносной холодильник, таким образом удается поддерживать температуру реакции не выше 60 С. [1]
Реакции разложения гидроперекисей такого типа, в том числе протекающие с участием катализаторов и других добавок, уже описаны в предыдущих главах. Последние образуются или непосредственно из гидроперекисей, или наряду с эпоксидами из перекисей при их распаде согласно описываемому ниже механизму. [2]
Реакция разложения гидроперекиси изопропилбензола сопровождается большим выделением тепла ( около 400 ккал / кг гидроперекиси), поэтому на практике приходится работать, со сравнительно низкими концентрациями гидроперекиси, что позволяет избежать перегрева и связанных с этим перебросов реакционной массы. [3]
Реакция разложения гидроперекиси грет-бут-ила в среде углеводорода рекомендована [455] в качестве модельной, когда нужно установить соотношение радикалов RO - и ROO -, образующихся на поверхности катализатора. Так, например, при распаде гидроперекиси трег-бутила в среде этилбензола в присутствии Ag2O скорости образования грег -: бутилового спирта и трет-бутил-а-фенилэтилперекиси близки, тогда как в случае VzOs спирта образуется вдвое больше, чем перекиси. Следовательно, в присутствии Ag2O окислительно-восстановительный цикл катализатора осуществляется по реакциям а и б ( стр. RO - и ROO, тогда как в случае VzO & катализ, по-видимому, протекает более сложным путем. [4]
На примере реакции разложения гидроперекиси кумила в присутствии диэтил - и дибутилдитиокарбамата никеля показано, что соотношение между скоростями образования свободных радикалов и молекулярных продуктов при 40 С примерно равно 0 2 и при 120 - 130 С стремится к единице. [5]
Кислотный катализ реакции разложения гидроперекисей в процессе окисления углеводородов указанными добавками и превращение реак-ционноспособных промежуточных продуктов реакции в устойчивые к окислению соединения осуществляется в рассматриваемом случае введением добавки одного вещества, выполняющего функции катализатора и реагента. Эти функции успешно выполняются борной кислотой и другими борсодержащими соединениями, обеспечивая высокую селективность процессов окисления углеводородов ( кроме ароматических) и некоторых их производных. Учитывая двойственный характер действия борной кислоты, можно, очевидно, моделировать ее действие добавками, содержащими два вещества: кислотный катализатор и вещество, реагирующее с одним из продуктов. [6]
В промышленности реакцию разложения гидроперекиси изопропилбензола осуществляют в присутствии очень малых количеств ( от 0 02 до 1 %) концентрированной серной кислоты ( 98 % - ной) при температуре 50 - 60 С. [7]
Вследствие большого теплового эффекта реакции разложения гидроперекиси на фенол и ацетон ( 2 103 кдж кг 486 ккал / кг) необходимо отводить выделяющееся тепло. В качестве среды, воспринимающей тепло, применяют изопро-пилбензол, фенол, ацетон или серную кислоту. [8]
В работе ( 11) исследована эффективность ряда 4 4 -тиобис-фенолов в реакциях разложения гидроперекиси кумрла. [9]
Реакции окисления ускоряются в присутствии ионов тяжелых металлов, например Со2, являющихся катализаторами реакции разложения гидроперекисей. [10]
Исходя из двухстадийного механизма образования бисфенола А из гидроперекиси изопропилбензола, целесообразно в начале реакции разложения гидроперекиси поддерживать более низкую температуру путем охлаждения и перемешивания реакционной массы. На следующем этапе дри конденсации фенола с ацетоном необходимо, во-первых, повысить температуру ж, во-вторых, ввести промотор для увеличения скорости конденсации. [11]
При нефтехимическом комбинате г. Борзешть еще в 1960 г. работает установка производства фенола и ацетона по реакции разложения гидроперекиси кумола. Полученный на этой установке фенол большей частью применяется при синтезе полиамидных синтетических волокон ( релон) по схеме: фенол - циклогексанол - - циклогексанон - циклогексанон оксим - е-капролактам. [12]
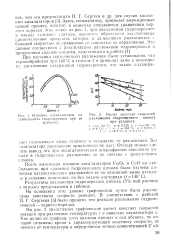
Как видно, во всех случаях зависимость lg ( C0 / C) от времени хорошо укладывается на прямой, проходящей через начало координат, что говорит о подчинении скорости реакции разложения гидроперекиси уравнению первого порядка. Вместе с тем различие в наклонах анаморфоз говорит о различии констант в случае разных исходных концентраций основания. [13]
Как видно, во всех случаях зависимость lg ( С0 / С) от времени хорошо укладывается на прямой, проходящей через начало координат, что говорит о подчинении скорости реакции разложения гидроперекиси уравнению первого порядка. Вместе с тем различие в наклонах анаморфоз говорит о различии констант в случае разных исходных концентраций основания. [14]
 |
Расчет констант скоростей. [15] |
Страницы: 1 2