Реакция - разложение - гидроперекись
Cтраница 2
На основании этих данных графическим путем были рассчитаны константы скорости реакций. В соответствии с работой П. Г. Сергеева [3] было принято, что реакция разложения гидроперекисей - первого порядка. [16]
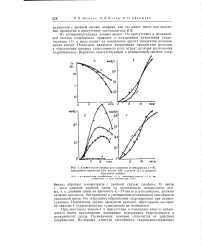 |
Кинетические кривые расхэдования углеводорода ( А. [17] |
Из экспериментальных данных видно, что присутствие в реакционной системе хлорбензола приводит к подавлению накопления гидроперекиси ( 1) и мало влияет на накопление других продуктов реакции, кроме кислот. Последние являются вторичными продуктами реакции, в образовании которых существенную роль играет реакция разложения гидроперекиси. [18]
Добавки ледяной уксусной кислоты не влияют, а добавки воды сильно замедляют реакцию кислотно-каталитического разложения указанных гидроперекисей. Уксусный ангидрид действует как сильный ускоритель реакции. Добавки метилэтилкетона и фенола до концентрации 0 1 - 0 5 моль. [19]
Сопоставление этих данных с полученными при инициировании окисления окислами металлов ( рис. 3, а и б), свидетельствует о том, что к окисним катализаторам нужно подходить дифференцированно. Из рис. 3, а видно, что при катализе закисью никеля ( катализатор малоактивный в реакции разложения гидроперекиси [.]) зависимость скорости образования ацетофенона ( Т АФ)) и диметилфенилкарбинола О дмФк), образующихся из RO, от RH аналогична зависимости, полученной при гомогенном инициировании окисления кумола азо-бмс-изобутиро-иитрилом. Для окислов, катализирующих распад гидроперекиси ( например, AgO), зависимости скоростей образования АФ и ДМФК от [ RH ] ( рис. 3, б) отличаются от зависимостей, полученных при инициировании окисления кумола закисью никеля. [20]
Такой механизм инициирования подтверждается и другими работами [168], в ходе которых было обнаружено, что при разложении гидроперекиси mpem - бутила в присутствии стирола образуется окись стирола. В работах с применением фенилнафтиламина и 2 6-ди-трет - бутил-п-крезола в качестве агентов обрыва цепи [149] удалось подтвердить первый порядок реакции разложения гидроперекиси тетралина, по крайней мере в начальных стадиях. Однако влияние природы растворителя оказалось значительно сильнее, чем можно было ожидать для мономолекулярной реакции. [21]
Продуктами окисления являются кислоты, которые могут солюбили-зировать ионы металла. Металлы могут значительно снижать энергию активации разложения гидроперекиси, иногда на 20 ккал / моль; так, ион двухвалентного железа снижает энергию активации в реакции разложения гидроперекиси кумола с 29 до 12 ккал / моль. [22]
Техническую гидроперекись направляют в реактор / / на разложение. Разложение осуществляют в избытке ацетона при 60 С. Тепло реакции разложения гидроперекиси отводится путем частичного испарения ацетона. [23]
Степень ненасыщенности понижается при последующем разложении первичной гидроперекиси. Таким же путем идет, повидимому, и каталитическое окисление, промотированное металлическим осмием2 или солями кобальта, марганца и меди. Но часто катализаторы ускоряют также реакции разложения гидроперекиси. [24]
Многочисленные исследования были посвящены механизму разложения гидроперекисей. Обычно в качестве моделирующего вещества использовали гидроперекиси тетралина или кумола. Установлено [125], что при низких концентрациях реакция разложения гидроперекиси тетралина имеет первый порядок; при более высоких концентрациях порядок ее изменяется вследствие инициирования радикалом НО - дополнительных цепей. При разложении образуются а-тетралон, а-тетралол, вода, кислород и некоторые другие продукты. Реакция ускоряется следами металлов, но относительные выходы различных продуктов не изменяются. На разложение влияет растворитель; это показывает, что промежуточные радикалы RO - и НО - взаимодействуют с растворителем, инициируя цепное разложение последнего. [25]
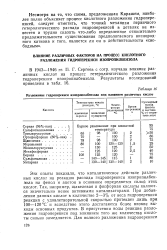 |
Разложение гидроперекиси изопропилбензола под влиянием различных кислот. [26] |
Эти опыты показали, что каталитическое действие различных кислот на реакцию распада гидроперекиси изопропилбен-зюла на фенол и ацетон в основном определяется силой этих кислот. Так, например, щавелевая и фосфорная кислоты являются значительно менее активными катализаторами. При добавлении данных кислот в количестве 2 - 3 % от веса гидроперекиси реакция с удовлетворительной скоростью протекает лишь при 100 - 120 С и вследствие этого достигаются более низкие выходы основных продуктов. В присутствии воды реакция разложения гидроперекиси под влиянием того же количества кислоты сильно замедляется. [27]
Несмотря на то, что перекиси часто образуются при хранении парафиновых и других углеводородов и получаются в виде промежуточных продуктов при окислении углеводородов до ке-тонов, спиртов и кислот, выделить эти соединения долгое время не удавалось. Несомненно, что основной причиной этого является относительная нестабильность перекисей, особенно содержащих примеси - других продуктов или катализаторов реакции аутоокисления. Концентрация перекисей при окислении обычно возрастает до некоторого максимума, величина которого зависит от соотношения скоростей их образования и разложения при определенных температуре и глубине превращения углеводорода. Та же закономерность наблюдается при окислении не только углеводородов, но и соединений иных классов. Реакции разложения гидроперекисей, происходящие при аутоокислении, приведены в гл. [28]
Страницы: 1 2