Реакция - разрушение
Cтраница 3
Бромид -, как и хлорид-ионы, не образует окрашенных соединений, кроме некоторых броморганических соединений. Поэтому в фотометрических методах определения бромида используются реакции разрушения окрашенных комплексных соединений, а также реакции окисления бромида до брома, который затем определяют, применяя реакции бромирования или окисления окрашенных органических соединений. [31]
Сульфат-ион не образует окрашенных соединений с каким-либо реактивом. Поэтому все фотометрические методы определения сульфатов основаны на реакциях разрушения окрашенных соединений. [32]
 |
Стадии формирования фигурного отверстия в пластине фотоситалла типа фотокерам. [33] |
При облучении ультрафиолетовым светом ( УФ) в полимерах развивается реакция разрушения связей, называемая реакцией деструкции. Поглощение фотонов происходит селективно и соответствует системе квантовомехаии-ческих уровней атома или молекулы. В сложных молекулах, в том числе и для полимеров, большое количество близко расположенных уровней формирует полосу поглощения. Совокупность полос поглощения образует спектр поглощения, специфика которого определяется молекулярной структурой полимера. [34]
Наконец, если энергия активации реакции не очень мала и не очень велика ( 40 - 120 кДж / моль), то такая реакция будет протекать не очень быстро и не очень медленно. Примером реакции, протекающей с измеримой скоростью, может служить приведенная выше реакция разрушения тиосульфата натрия серной кислотой ( см. стр. [35]
Фотометрические методы определения неметаллов являются менее разработанной областью фотометрического анализа по сравнению с методами определения металлов. Многие неметаллы не образуют окрашенных соединений, и фотометрические методы их определения основаны на реакциях разрушения окрашенных соединений. Большой интерес представляют реакции образования разнолигандных ( тройных, смешанных) комплексов, которые в последние 10 - 15 лет широко применяются в анализе. [36]
Как было отмечено выше, фотометрические методы определения анионов менее разработаны, чем катионов. На многие анионы нет цветных реакций, и в фотометрическом анализе для их определения применяют реакции разрушения окрашенных соединений. [37]
Однако общее количество озона получилось завышенным, а его широтные и сезонные изменения получились количественно неудовлетворительно. Этот недостаток объясняется как нарушениями фотохимического равновесия, так и не учитывавшимися в (8.4) - (8.6) реакциями разрушения озона в хлорном, азотном и водородном циклах. [38]
На участие в стадии (7.90) протонированных молекул ФГА указывает увеличение скорости диспропорционирования ФГА с понижением рН раствора. Хотя факт промежуточного образования нитрозоферроцена в ходе диспропорционирования не был подтвержден непосредственно, существование такой стадии представляется весьма вероятным, поскольку реакция разрушения ферроценовой системы с выделением неорганического железа является характерной для соединений данного класса, содержащих электроно-акцепторные группы. [39]
Сейчас редко можно встретить лаборатории, в которых, например, щелочные элементы определяли бы не методом фотометрии пламени, а фтор - не фотометрическим методом по реакции разрушения или образования окрашенного комплекса ионом фтора. При низком содержании элементов все реже применяются гравиметрические методы, уступая место более современным методам. [40]
Легко можно вычислить избыток CN - - HOHOB в растворе, необходимый для того, чтобы осаждение Ag2S не имело места. Уже указывалось на то, что константы нестойкости отражают приложимость к процессу комплексообразо-вания закона действующих масс. Они могут использоваться для весьма разнообразных расчетов, но следует при этом помнить, что возможность расчетного использования констант нестойкости отнюдь не свидетельствует о том, что реакции разрушения комплекса в действительности протекают за счет свободных центральных ионов, получающихся при вторичной диссоциации. [41]
Легко можно вычислить избыток CN - - IIOHOB в растворе, необходимый для того, чтобы осаждение Ag2S не имело места. Уже указывалось на то, что константы нестойкости отражают приложимость к процессу комплексообразо-вания закона действующих масс. Они могут использоваться для весьма разнообразных расчетов, но следует при этом помнить, что возможность расчетного использования констант нестойкости отнюдь не свидетельствует о том, что реакции разрушения комплекса в действительности протекают за счет свободных центральных ионов, получающихся при вторичной диссоциации. [42]
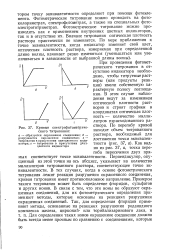 |
Кривые спектрофотометриче-ского титрования. [43] |
Как видно из рис. 37, а, точка перегиба пересечения двух прямых соответствует точке эквивалентности. Перпендикуляр, опущенный из этой точки на ось абсцисс, указывает на количество миллилитров титрованного раствора, соответствующее точке эквивалентности. В тех случаях, когда в основе фотометрического титрования лежит реакция разрушения окрашенного соединения, кривая титрования имеет противоположное направление. Примером такого титрования может быть определение фторидов, сульфатов и других ионов. В связи с тем, что эти ионы не образуют окрашенных соединений, для их фотометрического определения применяют методы, которые основаны на реакциях разрушения окрашенных соединений. [44]
Такой ступенчатый характер процесса является наиболее вероятным. Ограничение содержания алюминия в сплаве, как указывает М. Б. Рапопорт, определяется реакцией разрушения карбида алюминия кремнеземом: 2Al4C3 3SiO2 8Al 3Si 6СО, по которой образуется сплав с 72 % А1 и 28 % Si. Присутствие в системе железа улучшает условия для восстановительного процесса, поскольку оно облегчает начало восстановления кремнезема и глинозема. Железо, а также марганец и хром образуют тройные фазы с алюминием и кремнием: от FeAl4 5Si до FeAISi, Al2Mn3Si5, Al9Mn3Si, Al3CrSi и др., что также облегчает восстановление алюминия и кремния. [45]
Страницы: 1 2 3 4