Реакция - самоокисление
Cтраница 2
Происходящие при этом явления объясняются реакциями самоокисления - самовосстановления тиосерной кислоты. [16]
Почему разложение азотистой кислоты называют реакцией самоокисления - самовосстановления. Какой элемент здесь окисляется и какой восстанавливается. [17]
Окислительно-восстановительные потенциалы америция в растворах и реакции самоокисления и самовосстановления ( диспропорционирования) подробно освещены в работах иностранных [3-7] и русских [8-11] авторов. [18]
Уже давно было известно, что реакция самоокисления протекает в две стадии. На первой стадии ( индукционный период) происходят лишь незначительные изменения химических и физических свойств масел. Это объясняется главным образом присутствием антноксидантов. Но индукционный период можно рассматривать и как период накопления веществ, предшествующих реакции; при добавлении сиккативов или нагревании он сокращается. После индукционного периода происходит быстрое изменение химических и физических свойств масел. К изменениям физических свойств относятся повышение вязкости, плотности и показателя преломления. Это сопровождается изменениями ультрафиолетового и инфракрасного спектров поглощения, свидетельствующими об образовании перекисей, гидроксильных и карбоксильных групп, сопряженных двойных связей и полимеров. На ход реакции и состав конечных продуктов оказывают влияние следующие факторы. [19]
Образующийся ион тиосульфата рассматривается как активный катализатор реакции самоокисления сернистой кислоты до серной с одновременным выпадением в осадок элементарной серы. [20]
Из реакций окисления прежде всего необходимо упомянуть о реакции самоокисления. В этой реакции отражается исключительная реакционная способность сопряженной системы. Поглощение кислорода воздуха мономерами типа бутадиена [3146] часто сопровождается взрывом, что связано с образованием неустойчивой перекиси. [21]
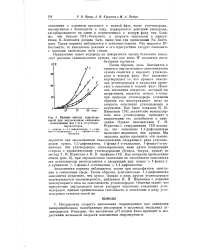 |
Кривые выхода гидроперекисей при эмульсионном окислении ( соотношение фаз в отсутствие эмульгаторов. [22] |
Присутствие ионов водорода на поверхности частиц бентонита замедляет реакцию самоокисления кумола, так как ионы Н являются ингибиторами процесса. [23]
Когда газообразный хлор пропускают через раствор NaOH, происходит реакция самоокисления - самовосстановления. [24]
Реакции окисления - восстановления можно разделить на несколько типов: реакции самоокисления - самовосстановления, внутримолекулярного окисления - восстановления и межмолекулярного окисления - восстановления. В последнем случае окислителем и восстановителем являются разные вещества. [25]
Реакции окисления - восстановления можно разделить ка несколько типов: реакции самоокисления - самовосстановления, внутримолекулярного окисления - восстановления и межмолекулярного окисления - восстановления. В последнем случае окислителем и восстановителем являются разные вещества. [26]
Вещества, проявляющие и окислительные, и восстановительные свойства, способны к реакциям самоокисления - самовосстановления. Такие реакции называют реакциями диспропорционирования. К реакциям диспропорционирования способны многие соединения. [27]
Азотистая кислота может проявлять окислительные и восстановительные свойства, а потому способна к реакции самоокисления - самовосстановления. [28]
Потенциалы пар гидратированных ионов плутония настолько близки между собой, что при определенных условиях протекают реакции самоокисления и самовосстановления ( диспропорциони-рования) четырехвалентного и пятивалентного плутония. В результате этих процессов может быть достигнуто равновесие ионов всех ступеней окисления. [29]
При рассмотрении механизма реакций органических соединений с кислородом, идущих при обычной температуре, - реакций самоокисления, как темновых, так и световых, наибольший интерес представляет не столько описание их кинетики с помощью стандартной схемы цепной реакции образующихся радикалов, сколько начальный этап. [30]
Страницы: 1 2 3