Реакция - взаимодействие - окись - углерод
Cтраница 1
Реакции взаимодействия окиси углерода, водорода и непредельных углеводородов при высоких давлениях, в результате которых в качестве первичных продуктов образуются альдегиды, содержащие на один атом углерода больше, чем исходный углеводород, получили название реакций оксосинтеза. [1]
Реакция взаимодействия окиси углерода с метиловым спиртом идет в присутствии никеля и иодида меди или йода при 250 - 330 и давлении окиси углерода 200 - 300 am; при этом 90 % метилового спирта переходят в уксусную кислоту; часть кислоты получается в виде метилового эфира уксусной кислоты. [2]
Реакция взаимодействия окиси углерода с водяным паром протекает без изменения числа молей. [3]
Реакции взаимодействия окиси углерода с гидроксилом и атомарным кислородом были детально изучены в работе [104], где установлено, что обе эти реакции совершаются по бимолекулярному механизму. [4]
Реакция взаимодействия окиси углерода с водородом ( метанирование) протекает с выделением большого количества тепла и с уменьшением объема. Давление процесса определяется общей технологической схемой производства аммиака. Температура зависит от активности применяемого катализатора, чаще всего она выбирается в пределах 150 - 350 С. [5]
Реакция взаимодействия окиси углерода с водяным паром протекает без изменения числа молей. [6]
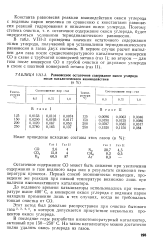 |
Равновесное остаточное содержание окиси углерода после каталитического взаимодействия. [7] |
Константа равновесия реакции взаимодействия окиси углерода с водяным паром невелика по сравнению с константами равновесия реакций гидрирования и окисления окиси углерода. [8]
Опыт показывает, что реакция взаимодействия окиси углерода с водяным паром протекает с отрицательным тепловым эффектом, следовательно, при понижении температуры равновесие будет сдвигаться в сторону образования водорода и двуокиси углерода. Однако при температуре ниже 1000 скорость взаимодействия СО с Н2О очень мала. Применение катализаторов ускоряет реакцию и дает возможность проводить ее при температурах порядка 450 - 550 со скоростью, удовлетворяющей производственным условиям. [9]
Опыт показывает, что реакция взаимодействия окиси углерода с водяным паром протекает с отрицательным тепловым эффектом, следовательно, при понижении температуры равновесие будет сдвигаться в сторону образования водорода и двуокиси углерода. Однако при температуре ниже 1000 скорость взаимодействия СО с НаО очень мала. [10]
С промышленной точки зрения реакция взаимодействия окиси углерода и водорода с олефинами представляет интерес как метод получения низкомолекулярных альдегидов и высших спиртов - лауринового, миристилового, гексадецилового, идущих на производство моющих средств. Додецен, гексадецен и другие высокомолекулярные олефины образуются при крекинге парафина. В принципе для реакции окоосннтеза могут быть использованы разнообразные олефины. [11]
При высокой активности внешней среды и при высокой скорости реакций взаимодействия окиси углерода с поверхностью стальных деталей процесс науглероживания подчиняется указанным ниже закономерностям. [12]
Имеется глубокая внутренняя связь между всеми этими процессами, основанными на реакциях взаимодействия окиси углерода с водородом, и прогресс одного из них содействует развитию остальных. [13]
В качестве яркого примера к сказанному может служить специфическая избирательность катализаторов в реакции взаимодействия окиси углерода с во-цородом. [14]
В работах Лаврова, Гребенщиковой [121, 122] показано влияние природы углеродистого материала и неорганических примесей, присутствующих в золе лисичанских углей, на скорость реакции взаимодействия окиси углерода с водяным паром. [15]
Страницы: 1 2