Реакция - взаимодействие - хлор
Cтраница 2
Позднее было установлено, что при фотохимическом проведении реакции взаимодействия хлора с водородом на каждый поглощенный квант света в реакцию может вступить не по одной только молекуле хлора и водорода, а значительно большее число их. [16]
Вопреки представлениям о чрезвычайной легкости присоединения хлора по двойной связи, реакция взаимодействия хлора с этиленом в газовой фазе почти не идет [20] и является чисто каталитической реакцией, протекающей на стенках аппарата, причем скорость ее пропорциональна отношению поверхности к объему аппарата. [17]
Из табл. 4 ( опыты № 1, 2) видно, что реакция взаимодействия хлора с глиноземом золы протекает при указанных условиях медленно, при этом выход хлористого алюминия при температуре 1150 С только немного выше, чем при 1000 С. [18]
В случае выделения хлора при электролизе растворов хлоридов на основной процесс образования хлора накладываются реакции взаимодействия хлора с водой ( гидролиз) и последующих превращений образующихся веществ. [19]
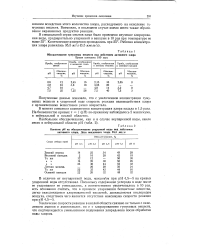 |
Обесцвечивание гумусовых веществ под действием активного хлора.| Влияние рН на обесцвечивание упаренной воды под действием активного хлора. Доза введенного хлора 35 5 мг / л. [20] |
Полученные данные показали, что с увеличением концентрации гумусовых веществ в упаренной воде скорость реакции взаимодействия хлора с органическими веществами резко возрастала. [21]
Эта реакция подробно изучена русским химиком А. А. Яковки-ным ( 1899), работы которого пролили свет на реакции взаимодействия хлора со щелочью. Действительно, равновесие реакции ( а) легко сместить вправо, добавив щелочь. [22]
Эта реакция подробно изучена русским химиком А. А. Яковкиным ( 1899 г.), работы которого пролили свет на реакции взаимодействия хлора со щелочью. Действительно, равновесие реакции ( а) легко сместить вправо, добавив щелочь. [23]
Эта реакция подробно изучена русским химиком А. А. Яков-киным ( 1899 г.), работы которого пролили свет на реакции взаимодействия хлора со щелочью. [24]
Температура обработки определяет скорость хлорирования и количество поглощенного хлора. Реакции взаимодействия хлора с лигнином и углеводами имеют положительные температурные коэффициенты, следовательно, повышение температуры ускоряет хлорирование. Однако повышение температуры усиливает гидролиз хлора, вследствие чего возрастает концентрация хлорноватистой кислоты, усиливаются процессы окислительной деструкции целлюлозы. [25]
Скорость цепной реакции может быть значительно увеличена воздействием малых добавок веществ, способных образовывать свободные радикалы и увеличивать скорость зарождения цепей. Так, реакция взаимодействия хлора с водородом при невысоких температурах в темноте не идет. [26]
Процесс, изображенный уравнением ( А), называется гидролизом хлора. Работы Яковкина пролили свет на реакции взаимодействия хлора со щелочью. [27]
Все галоиды способны вступать в реакцию с каучуком, но каждый из них оказывает несколько отличное действие. Действие фтора на каучук пока мало изучено, но, учитывая интерес, проявляемый в последнее время к фторированным полимерам, можно ожидать развития исследований в этой области. Реакции взаимодействия хлора с каучуком широко изучены. Теоретически каучук должен был бы присоединять одну молекулу С12 по каждой двойной связи с образованием соединения, содержащего 51 % хлора. Однако практически трудно остановить хлорирование на 51 %, и хлорированные кау-чуки - содержат от 65 до 70 % связанного хлора, что примерно соответствует четырем атомам хлора на один изопреновый остаток ( см. стр. При действии брома получается продукт более определенного состава, соответствующий присоединению одной молекулы брома по каждой двойной связи. Наиболее интересным свойством бромированного каучука является его способность вступать в реакции Фриделя - Крафтса. [28]
В пробирку кладут немного, так чтобы лишь прикрыть дно, окислителя и капают при помощи пипетки 3 - 4 капли концентрированной соляной кислоты. Но в крайнем случае можно использовать и перманга-нат калия, который в отличие от бертолетовой соли дает темный раствор и во многих случаях мешает разглядеть продукты реакции взаимодействия хлора с некоторыми веществами, например медью и железом. [29]
Сухой хлор как в газообразном, так и в жидком состоянии при температурах, не превышающих 100 С, практически не взаимодействует с металлами и сплавами. При влажности хлора 0 001 % не обнаруживается какой-либо заметной разницы в коррозионном поведении всех металлов. Скорость коррозии не превышает 0 02 мм / год. С повышением температуры скорость реакции взаимодействия хлора с металлами возрастает до критической температуры, определяемой химическим составом материала. При температурах выше критической разрушение металла протекает с большой скоростью, что связано с плавлением и испарением образующейся в процессе коррозии защитной пленки из хлоридов. [30]
Страницы: 1 2 3