Реакция - синтез - метанол
Cтраница 3
Кроме того, Натта показал, что в смешанных катализаторах окись цинка - полуторный окисел, последний предохраняет окись цинка от утомления, если в условиях реакции синтеза метанола ( 400 - 500) эти окислы не дают с окисью цинка шпинели. Шпинель оказывает, по мнению Натта, защитное действие лишь постольку, поскольку она препятствует спеканию катализатора при температурах реакции. [31]
 |
Схема агрегата синтеза метанола. [32] |
А, В, С, D - константы, зависящие от температуры; / Нг, / со, / сн3он - летучести компонентов; К - константа равновесия реакции синтеза метанола. [33]
Образующиеся при синтезе побочные продукты оказывают существенное влияние на стадию хемосорбции и на кинетику образования метанола в целом. Поэтому, для реакции синтеза метанола предложено большое количество различных кинетических уравнений, выведенных на основе выдвинутых их авторами предположений о механизме реакции. [34]
Оба эти уравнения выведены в развитие предложенных Темкиным и Чередниченко теоретических уравнений, предполагающих, что лимитирующей стадией процесса синтеза метанола является адсорбция водорода [ уравнение ( V-6) ] или адсорбция окиси углерода [ уравнение ( V-1. Таким образом, реакция синтеза метанола, по-видимому, относится к сложным процессам, лимитирующая стадия которых в зависимости от условий может меняться. [35]
Исследуя влияние давления на скорость реакции, нужно помнить о том, что стехиометрические уравнения большинства химических реакций не отражают их механизма и в действительности превращение проходит как несколько следующих одна за другой простых реакций разного порядка. В качестве примера можно использовать реакцию синтеза метанола СО 2Н2 СН3ОН, которая протекает не как реакция третьего порядка, а, вероятно, как две последовательные реакции второго порядка. Поскольку влияние давления на скорость реакции меньше в случае реакций более низкого порядка, теоретическое предвидение такого влияния не может быть основано на стехиометрическом уравнении реакции. Если механизм процесса неизвестен, то обязательно нужно определить порядок кинетического уравнения экспериментальным путем. [36]
Непосредственное экспериментальное определение равновесного состава реакционной смеси при синтезе метанола, проведенное рядом исследователей ( табл. V-1), не дает надежных результатов вследствие усложнений, вызываемых протеканием побочных реакций. Поэтому единственно правильным путем определения равновесия реакции синтеза метанола является расчет. [37]
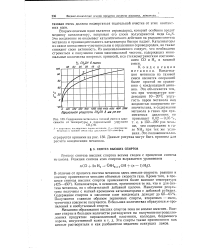 |
Содержание метанола в газовой смеси в зависимости от температуры и парциальной упругости СН. 1ОН. [38] |
Вторым опасным ядом является сероводород, который особенно вредит медному катализатору, покрывая его слоем полусернистой меди Cu. Это соединение не оказывает каталитического действия на реакцию синтеза метанола и производительность катализатора быстро падает. Катализаторы из окиси цинка менее чувствительны к отравлению сероводородом, но также снижают свою активность. [39]
Теоретические вычисления константы равновесия синтеза метанола были выполнены преимущественно на основе третьего закона термодинамики. В настоящее время можно полагать, что наиболее теоретически обоснованным расчетом константы равновесия реакции синтеза метанола является термодинамический расчет М. И. Темкина и Чередниченко3, которые впервые учли, что пары метанола заметно ассоциированы. [40]
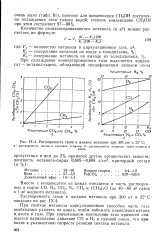 |
Растворимость газов в жидком метаноле при 300 am и 25 С. [41] |
При синтезе метанола циркуляционным способом часть газа необходимо удалять из цикла, чтобы избежать накопления метана и азота в газе. При значительном накоплении этих примесей снижается парциальное давление СО и Н2 в газовой смеси, что приводит к уменьшению скорости реакции синтеза метанола. [42]
Газ для синтеза должен быть очищен от инертных газов ( СО2 и N2), которые, будучи примешаны к реакционным rasaiM, понизят парциальное давление СО и Н2 и тем самым уменьшат скорость реакции синтеза метанола. [43]
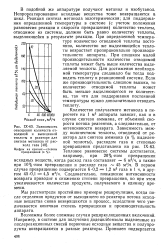 |
Зависимость отношения количеств отводимой и выделенной теплоты в реакторе для синтеза метанола от расхода газа. [44] |
В подобной же аппаратуре получают метанол и изобутанол. Непрореагировавшие исходные вещества тоже возвращаются в цикл. Реакция синтеза метанола экзотермическая; для поддержания определенной температуры в системе ( с учетом положения равновесия реакции и скорости превращения) количество теплоты, отводимое из системы, должно быть равно количеству теплоты, выделяющейся в результате реакции. [45]
Страницы: 1 2 3 4