Реакция - синтез - углеводород
Cтраница 2
В 1935 - 1945 гг. Фишер совместно с Пихлером [496] исследовали реакции синтеза углеводородов с применением средних давлений - 5 - 20 атм. Оказалось, что при таких давлениях с применением кобальтовых катализаторов в 10 раз увеличивается выход твердых парафинов, на 20 % повышается выход жидких углеводородов, продукты реакции становятся более насыщенными, катализатор работает весьма устойчиво. [16]
Сравнительно немного известно о некоторых синтетических реакциях, которые очень близко напоминают реакции синтеза углеводородов из окиси углерода и водорода. Эти реакции заслуживают краткого упоминания, так как они также, вероятно, регулируются геометрическими факторами. Оксосинтез [15] альдегидов путем взаимодействия этилена или других олефинов с окисью углерода и водородом проводится в присутствии кобальтовых катализаторов при температурах в пределах 110 - 150 и под давлением 100 - 200 атм. Подобным же образом, как и этилен, реагируют циклические олефины, например циклогексен дает гексагидробензальдегид. [17]
Как справедливо отмечалось в литературе [1], открытие Коль-белем и Энгельгардтом [2] реакции синтеза углеводородов и спиртов непосредственно из водяного пара и окиси углерода, исключая предварительное получение дорогостоящего водорода, значительно расширяет возможности промышленности синтеза искусственного жидкого топлива и химических продуктов. Дальнейшее развитие работ в этой области [3] показало возможность использования в качестве сырья для этого синтеза дешевого, иногда просто не находящего использования доменного газа. Исследования реакции синтеза из окиси углерода и водяных паров, начатые в ИГИ АН СССР [4] подтвердили, в основном, результаты немецких ученых. [18]
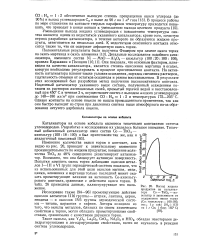 |
Выход жидких продуктов на катализа. [19] |
Такие окислы, как Y2O3, La2O3, CeO2, Nd2O3 и НЮ2, обладая некоторыми дегидратирующими и дегидрирующими свойствами, почти не изучались в реакции синтеза углеводородов. [20]
По исследованию синтеза над Ni - Al203 - MnO катализатором, проведенному В. А. Каржавиным, и синтеза над Co - Th02 - MgO катализатором, проведенному Д. И. Орочко и К. А. Королевой, скорость реакции синтеза углеводородов описывается уравнением первого порядка. [21]
По исследованию синтеза над Ni - Al2O3 - MnO катализатором, проведенному В. А. Каржавиным, и синтеза над Co - ThO2 - MgO катализатором, проведенному Д. И. Орочко и К. А. Королевой, скорость реакции синтеза углеводородов описывается уравнением первого порядка. [22]
Железные катализаторы более эффективны, и существенным их преимуществом по сравнению с кобальтовыми катализаторами является возможность придания процессу синтеза большей гибкости. Изменяя состав катализатора, метод его приготовления и восстановления, можно управлять реакцией синтеза углеводородов. Кроме того, железные катализаторы высокопроизводительны и достаточно дешевы. [23]
Данные Крэксфорда [17] показывают, что при наличии в газе синтеза ( до 50 %) метана последний участвует в реакции синтеза углеводородов из СО и Н2 на кобальтовом катализаторе. Данные Преттра [18] показывают, что для участия метана в синтезе необходимы значительно большие концентрации метана ( около 90 %) в газе синтеза и специальные катализаторы. Эти работы нуждаются в повторении и проверке, причем необходимо обратить особенно большое внимание на точность газовых анализов и материальных балансов. [24]
Страницы: 1 2