Реакция - обменное взаимодействие
Cтраница 1
Реакции обменного взаимодействия, являющиеся едва ли не самым распространенным типом реакций в солевых расплавах ( обменное разложение), в двойных жидких системах встречаются тоже достаточно часто, хотя значительно реже, чем реакции присоединения. Возможность прохождения реакции этого типа часто не принимается во внимание исследователями, что приводит к значительным ошибкам. [1]
Так, реакция обменного взаимодействия алифатических тиолов и дисульфидов в среде ароматических углеводородов идет очень медленно даже при 200 С. Энергия активации этой реакции составляет 28 ккал / моль. Обмен ароматических тиолов и дисульфидов в аналогичных условиях протекает тем не менее довольно легко даже при значительно более низких температурах с энергией активации 10 ккал / моль. Скорость реакции пропорциональна корню квадратному из концентрации дисульфида и не зависит от концентрации тиола. [2]
 |
Микрофотография осадка силиката свинца, находившегося в контакте с маточным раствором. [3] |
Под действием реакции обменного взаимодействия изменяются физико-химические свойства системы. Повысился рН суспензии с 7 8 до 8 7; первичная и вторичная структуры осадка претерпели необратимые изменения. [4]
На примерах реакций обменного взаимодействия солей можно показать, что таким путем особенно легко получить соли, нерастворимые в воде. [5]
Поэтому константа равновесия реакции обменного взаимодействия может быть найдена с большей точностью, чем константа равновесия реакции аддатационного взаимодействия. [6]
Здесь целесообразно познакомить учащихся с получением соли реакцией обменного взаимодействия двух солей. Необходимо подчеркнуть, что таким путем особенно легко получить соли, нерастворимые в воде. [7]
Следует отметить, что в тех случаях, когда реакция обменного взаимодействия протекает с изменением числа молекул, положение экстремума на изотерме Дг / будет зависеть от величины К. [8]
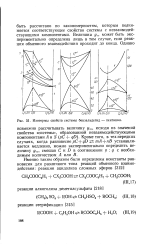 |
Изотермы свойств системы бензальдегид - пентанол. [9] |
Величина у может быть экспериментально определена лишь в том случае, если реакция обменного взаимодействия проходит до конца. [10]
Большое значение в металлургии имеют: а) реакции металлов с водой и кислотами; б) реакции обменного взаимодействия с соединениями других металлов. [11]
 |
Интегральная и дифференциальная кривые распределения по молекулярным весам полиарилата Д-9. [12] |
Тем не менее и у полиарилатов, содержащих в цепи объемистые заместители, при высоких температурах все же протекают реакции обменного взаимодействия. Во всех других случаях деструкции в качестве исходного полимера был использован высокомолекулярный полиарилат Д-9 ( 2 - й образец, табл. 25); соотношение полиарилат ( повторяющееся звено): деструктирующий агент всегда составляло 1: 1 моля. [13]
Оно объединяет свойство равновесной смеси у со свойствами компонентов системы у А и у в, продуктов реакции ус и у0, аналитическим составом системы х и константой равновесия реакции обменного взаимодействия / С. В отличие от реакций аддатационного взаимодействия все параметры, входящие в уравнение ( 111 3), определенны, и поэтому расчет константы равновесия реакции обменного взаимодействия может быть выполнен с большей точностью, чем в случае реакции образования продукта присоединения. [14]
Уравнение ( 111 9) позволяет, зная величины свойства равновесной смеси и свойств начальной у0 и конечной смеси г / оо, рассчитывать величины равновесного соотношения, а затем по уравнению ( 111 8) выход реакции обменного взаимодействия. [15]
Страницы: 1 2 3