Реакция - указанный тип
Cтраница 2
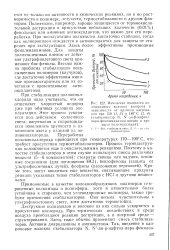
Приложение 8.7. Скалярная теория, изложенная в приложении 8.2, связана с превращением одного реагента при изотермической каталитической реакции. Предположим теперь, что мы имеем систему N реагентов, каждая компонента которой подвергается реакции указанного типа и при этом, с одной стороны, испытывает влияние остальных N - 1 компонент, а с другой стороны, сама влияет на остальные компоненты. [16]
Некоторые галогениды или окислы металлов восстанавливаются щелочными металлами, давая промежуточные продукты, которые вступают в последующую реакцию с источниками водорода, например с водородом, водой, кислотой и так далее, образуя связи металл-водород. Щелочные металлы можно использовать как таковые или в активированной форме, например в виде амальгамы или аддукта с нафталином. Реакции указанного типа не нашли широкого применения в синтезе гидридов металлов, но они имеют потенциально важное значение для получения высо-кореакционноспособных промежуточных продуктов в низших валентных состояниях. [17]
Многочисленные ароматические амины и соединения других классов, содержащие первичные, вторичные или третичные аминные группы, реагируют с солями кобальта с образованием комплексных окрашенных соединений. Возможен и иной характер взаимодействия, когда ион кобальта вытесняет водород амино - или иминогруппы, как это происходит в случае бензимидазола. Реакции указанных типов осуществляются при взаимодействии кобальта с бензидином [302, 424, 696, 1346], о-фенилендиамином [658], ( 3-нафтиламином [625], о-фенилен-гуанидином [645], антипирином [1419, 1500], дициандиамидом [780], 1 2-диаминоантрахинонсульфокислотой [648, 1426], пиперидином [698], 2 - ( 2-пиридин) - пирролом [672, 673], бензимидазолом, дифенилкарбазидом [791], глиоксалином [706], родамином [769], галлоцианином [643, 650], 1-фенил - 3-метил - 5-пиразолоном [644, 646, 647] и др. Практическое значение для обнаружения кобальта имеют только некоторые из этих реагентов. [18]
Диазометан реагирует с некоторыми гидридными комплексами металлов с образованием соответствующих метальных производных. Область применения данной реакции ограничена из-за нестабильности и токсичности диазометана. Примером реакции указанного типа является превращение HW ( n - C5H5) ( СО) 3 [35] и HMn ( CO) s [347] в метальные аналоги. [19]
Как указывает Гюттиг [80], в случае смешанных окисных катализаторов и катализаторов, состоящих из смесей соль - окись ( BaO - CuSO4 и BaO - ZnSO4), может происходить образование соединений, обладающих более высокой каталитической активностью. Превращение смеси в эти соединения не является скачкообразным, но происходит через индивидуальные промежуточные состояния, которые не обнаруживают характерных рентгенограмм. Можно ожидать, что реакция указанного типа будет протекать в течение длительных периодов времени, а именно периодов того же порядка, что и периоды старения или хранения, необходимые для получения катализаторов с оптимальной активностью. Повышение давления при формовании или применение метода, позволяющего получать более однородную смесь реагентов, увеличивают вероятность образования соединений. Известно, что размер зерен, тип носителя и молярный состав оказывают влияние на активность реагента, содержащего перманганат серебра. Тот факт, что имеет место влияние молярного состава, свидетельствует в пользу теории, согласно которой может происходить образование указанных соединений. [20]
Скорости соответствующих реакций неодинаковы. Дибензил и п п - ди-анизоил реагируют, как правило, значительно медленнее, чем фенантренхинон, ретенхинон и хризенхинон; трикетоиндан обладает умеренной реакционной способностью. Показано, что большое число этиленов обладает способностью вступать в реакции указанного типа. [21]
С, что требует присутствия термостабилизаторов. Процесс термодеструкции осложняется еще и окислительными реакциями. Кроме того, могут вводиться еще вещества, связывающие продукты реакции указанных типов стабилизаторов с НС1 и другими веществами. [23]
Переработка поливинилхлорида проводится при температурах 170 - 190 С, что требует присутствия термостабилизаторов. Процесс термодеструкции осложняется еще и окислительными реакциями. Кроме того, могут вводиться еще вещества, связывающие продукты реакции указанных типов стабилизаторов с НС1 и другими веществами. [25]
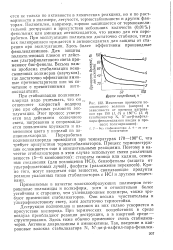
Если ф1 и особенно если р 1, то в большинстве случаев это значит, что первичные фотохимические продукты дают начало экзотермическим цепным реакциям, протекающим по атомно-радикальному механизму. К их числу относятся реакции галоидирования, сульфохлорирования, окисления и полимеризации. Средняя длина цепи в этих реакциях определяется величиной ср. По аналогии с реакциями, которые инициируются атомами или радикалами, реакции указанного типа называют цепными реакциями с фотоинициированием. [26]
При стабилизации поливинилхлорида надо учитывать, что он отщепляет хлористый водород уже при обычных условиях эксплуатации. Этот процесс ускоряется под действием солнечного света, нагревания и сопровождается появлением хрупкости и изменением цвета у изделий из поливинилхлорида. Переработка поливинил-хлорида осуществляется при температурах 170 - 190 С, что требует присутствия термостабилизаторов. Процесс термодеструкции осложняется еще и окислительными реакциями. Кроме того, могут вводиться еще вещества, связывающие продук ты реакции указанных типов стабилизаторов с НС1 и другими веществами. [27]
К первому относятся: реакции между элементарными ионами; такие, например, как Ag С1 - - AgCl. Они сопровождаются значительным выигрышем свободной энергии, а их кинетика определяется скоростью, с которой катионы и анионы вступают в контакт, или скоро - стью, с которой ионы одного или другого типа частично десольвати-руются. Одна из таких реакций, представляющих большой интерес для химии в целом, - реакция рекомбинации ионов водорода и гид-роксила в водных растворах ( Н ОН - - Н20) - изучена весьма тщательно. Реакции второго типа такие, как 1 - СН2ВгСОО - - - Вг - СНЛСОО, также, по-видимому, относятся к ионным, однако по существу это взаимодействие между ионами 1 - и полярными группами С-Вг, в которых атом углерода соединен ковалентно с заряженной группой. Эти реакции между ионами аналогичны реакциям типа I СН3Вг - - Вг - - Ь CHSI и отличаются от них только тем, что при атоме углерода имеется заряженная группа СОО, которая непосредственно в химическом акте не участвует. В этой главе мы рассмотрим процессы именно последнего типа. Вначале мы кратко наметим тот путь, который привел к формированию современных представлений о механизме ионных реакций в растворах. Окончательные выводы, касающиеся кинетики реакций указанного типа, могут быть сделаны только в результате сопоставления мгновенной скорости реакции с произведением активностей, причем активности должны быть установлены не кинетическим методом, а, например электрометрически или по данным о растворимости. Бренстед [21] предложил теорию ионных реакций, которая удовлетворительно объясняла кинетический смысл понятия активности. [28]
К первому относятся реакции между элементарными ионами, такие, например, как Ag CI - AgCl. Они сопровождаются значительным выигрышем свободной энергии, а их кинетика определяется скоростью, с которой катионы и анионы вступают в контакт, или скоростью, с которой ионы одного или другого типа частично десольвати-руются. Одна из таких реакций, представляющих большой интерес для химии в целом, - реакция рекомбинации ионов водорода и гид-роксила в водных растворах ( Н ОН - у Н20) - изучена весьма тщательно. Вг СНЛСОО, также, по-видимому, относятся к ионным, однако по существу это взаимодействие между ионами I и полярными группами С-Вг, в которых атом углерода соединен ковалентно с заряженной группой. Эти реакции между ионами аналогичны реакциям типа I СН3Вг - - - Br - f CHSI и отличаются от них только тем, что при атоме углерода имеется заряженная группа СОО, которая непосредственно в химическом акте не участвует. В этой главе мы рассмотрим процессы именно последнего типа. Вначале мы кратко наметим тот путь, который привел к формированию современных представлений о механизме ионных реакций в растворах. Окончательные выводы, касающиеся кинетики реакций указанного типа, могут быть сделаны только в результате сопоставления мгновенной скорости реакции с произведением активностей, причем активности должны быть установлены не кинетическим методом, а, например электрометрически или по данным о растворимости. Бренстед [21] предложил теорию ионных реакций, которая удовлетворительно объясняла кинетический смысл понятия активности. [29]
Страницы: 1 2