Реакция - титрование
Cтраница 1
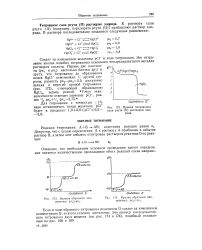 |
Кривая титрования соли ртути ( II раствором хлорида.| Кривая обратного титрования. p / c0pfi. [1] |
Реакция титрования: А4 - В - АВ; константа реакции равна кг. [2]
Реакция титрования не обязательно должна проходить полностью вблизи точки эквивалентности. Можно провести измерения в нескольких точках, достаточно удаленных от точки эквивалентности ( где реакция проходит еще количественно), и найти затем точку эквивалентности графически. [3]
 |
Константы устойчивости некоторых комплексов металлов с ЭДТА при 20 С и ионной силе раствора, равной 0 1 моль / дм3. [4] |
Реакция титрования моделируется логарифмической кривой, которую строят в координатах рМ - объем ЭДТА. Для более точных расчетов используют функцию а - коэффициент, учитывающий конкурентные реакции протонирования ( см. разд. [5]
Реакция титрования представляет собой простой перенос протона независимо от используемого растворителя. [6]
Реакция титрования должна быть быстрой. Комплексонаты многих металлов образуются медленно. Прямое титрование легко гидроли-зуемых катионов, например катионов алюминия и циркония, также связано с трудностями, такими, как возникновение размытых конечных точек титрования и занижение результатов. [7]
 |
Классификация тнтрнметрическнх методов. [8] |
Реакция титрования должна отвечать следующим требованиям: 1) быть строго стехиометричной; 2) протекать быстро; 3) протекать количественно, поэтому константа равновесия должна быть высокой; 4) должен существовать способ фиксирования точки эквивалентности. [9]
Реакция титрования не обязательно должна проходить полностью вблизи точки эквивалентности. Можно провести измерения в нескольких точках, достаточно удаленных от точки эквивалентности ( где реакция проходит еще количественно), и найти затем точку эквивалентности графически. [10]
Реакция титрования может быть представлена следующей схемой: НА ОН - Н2О А -, где А - [ соль ], а [ НА ] - [ органическая кислота ]; прибавляемые гидро-ксильные ионы тотчас же расходуются, так что [ ОН - ] создается за счет диссоциации воды. [11]
 |
Типы кривых фотометриче-ского титрования. [12] |
Реакция титрования определяемого вещества А с тит-рантом В, сопровождающаяся образованием продукта реакции С, может быть осуществлена в безындикаторном варианте, если хотя бы одно из упомянутых веществ обладает собственным поглощением при условиях титрования. [13]
Реакцией титрования обычно ( но не всегда) является реакция окисления - восстановления. До начала титрования ток между электродами или очень мал, или вообще не наблюдается, так как в отсутствие окислительно-восстановительной пары при столь малой разности потенциалов электродные процессы не происходят. Введение титранта вызывает появление в анализируемом растворе двух окислительно-восстановительных пар, причем до точки эквивалентности в растворе в заметных количествах будут находиться компоненты пары, образованной титруемым веществом, а после точки эквивалентности - компоненты, образованные титрантом. [14]
Если реакция титрования приводит к изменению концентраций окислителя и восстановителя, то изменяется и потенциал равновесия. [15]
Страницы: 1 2 3 4