Реакция - водород
Cтраница 3
В реакциях водорода, связанного с углеродом, как правило, нуклеофильная атака не приводит к отрыву гидрид-иона. [31]
Наоборот, реакция водорода из газовой фазы на никелевой пленке, насыщенной этиленом, протекает медленно и дает примерно 10 % С2Н6 и 90 % более сложных углеводородов. [32]
Наиболее известны реакции водорода с ненасыщенными молекулами ( см. гл. [33]
Поскольку многие реакции водорода ( и его соединений) сильно экзотермичны - как, например, его реакция с кислородом - водород ( и соединения, содержащие водород) часто используют в качестве горючего. [34]
Поэтому в реакции водорода с бромом обрыв цепей осуществляется в основном по реакции 2Вг Вг2, в то время как в реакции с хлором в присутствии кислорода превалирует обрыв на кислороде. [35]
Константа равновесия реакции водорода с сернистыми соединениями при температурах 300 - 420 С с образованием сероводорода и углеводорода очень велика, т.е. реакция практически протекает до конца. [36]
Сложный механизм реакции водорода с кислородом подтвержден многочисленными опытными данными, в том числе и прямым измерением концентраций активных центров Н, О, ОН [25-29], которые оказались сверхравновесными, во много раз превышающими их термодинамически равновесные значения. [37]
При инициировании реакции водорода с кислородом атомами кислорода путем фоторазложения молекулярного кислорода при низких температурах в продуктах реакции, наряду с перекисью водорода и водой, был обнаружен также озон. При обогащении гремучей смеси водородом доля озона в продуктах уменьшается. Согласно работе Неуймина и Попова ( 85), исследовавших фотохимическую реакцию окисления водорода при очень низких давлениях, из образующихся 2 атомов кислорода реакциоспособным является лишь возбужденный атом кислорода. [38]
Кинетические цепи реакции водорода с хлором, а также реакции хлорирования алканов очень длинны. Примером гомолитической реакции с малой длиной кинетической цепи является нитрование алканов азотной кислотой в газовой фазе. Укорочение цепи обусловливается конкурирующей побочной реакцией окисления. [39]
Детальный механизм реакции водорода с кислородом очень сложен, так как он включает огромное число элементарных реакций. [40]
Таким образом, реакция водорода с иодом обратима. [41]
Объем выделившегося при реакции водорода эквивалентен количеству растворенного металла и может служить количественной оценкой степени коррозионного разрушения. [42]
В отличие от реакции водорода с хлором реакция водорода с кислородом следует механизму разветвленных цепей. [43]
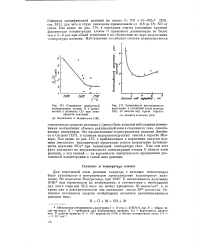 |
Отношение измеренной концентрации атомов О к равновесной в пламенах СО при атмосферном давлении.| Зависимость интенсивности излучения в сплошной части спектра от высоты над краем горелки. [44] |
Для гомогенной зоны реакции водорода с сильным теплоотводом было установлено и нетермическое происхождение характерного излучения. По подсчетам Кондратьева, при 1000 К интенсивность излучения ( ОН) при термическом их возбуждении, в соответствии с необходимой для этого энергией 92 5 ккал, не может превышать 50 квант / сек, в то время как в действительности она составляет около 1014 квант / сек. [45]
Страницы: 1 2 3 4