Реакция - трансаминирование
Cтраница 2
Чтобы понять роль глутаминовой кислоты в обмене других аминокислот, следует ознакомиться с еще одним процессом превращения аминокислот - реакцией трансаминирования. [16]
Печень, кроме того, обеспечивает сбалансированный пул свободных аминокислот организма путем синтеза заменимых аминокислот и перераспределения азота в результате реакций трансаминирования. [17]
Канаи и Мицуи [34] предложили схему 28А ( в которой водород атакует с менее затрудненной стороны снизу плоскости чертежа) в качестве модели реакции трансаминирования. [18]
Согласно гипотезе, получившей экспериментальное подтверждение, все или почти все природные аминокислоты ( исключение составляет метионин) сначала реагируют с а-кетоглутаровой кислотой в реакции трансаминирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глу-таматдегидрогеназы. [19]
Эта группа цистеина весьма реакционноспособна; она может окисляться как спонтанно, так и под влиянием специальных ферментов; образующиеся при этом продукты, как и сам цистеин, участвуют в реакциях трансаминирования. Цистеин участвует также в обмене серы в организме. Расщепление цистеина под влиянием десульфогидрогеназы приводит к образованию пировиноградной кислоты и сероводорода. [20]
Реакции трансаминирования являются обратимыми и, как выяснилось позже, универсальными для всех живых организмов. Теоретически реакции трансаминирования возможны между любой амино - и кетокислотой, однако наиболее интенсивно они протекают в том случае, когда один из партнеров представлен дикарбоновой амино - или кетокислотой. В тканях животных и у микроорганизмов доказано существование реакций трансаминирования между монокарбоновыми амино - и кетокислотами. Донорами NH2 - rpynnbi могут также служить не только а -, но и 3 -, у - и со-аминогруппы ряда аминокислот. Майстера доказано, кроме того, трансами-нирование глутамина и аспарагина с кетокислотами в тканях животных. [21]
Все трансаминазы ( как и декарбоксилазы аминокислот) содержат один и тот же кофермент-пиридоксальфосфат. Для реакций трансаминирования характерен общий механизм. Специфичность трансаминаз обеспечивается белковым компонентом. Ферменты трансаминирования катализируют перенос NH2 - rpynnbi не на а-кетокислоту, а сначала на кофермент пиридоксальфосфат. [22]
Кофермент А содержит активные SH-группы и катализирует реакции переноса ацильного остатка in vivo, в частности в биосинтезе жирных кислот. Пиридоксальфосфат катализирует реакции трансаминирования и декарбоксилирования аминокислот, в то время как тиаминпирофосфат участвует в метаболизме пентоз и в биохимических реакциях а-кетокислот. [23]
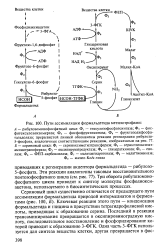 |
Пути ассимиляции формальдегида метилотрофами. [24] |
Ключевая реакция этого пути - конденсация формальдегида и глицина в присутствии тетрагидрофолиевой кислоты, приводящая к образованию серина. Последний в реакции трансаминирования превращается в оксипировиноградную кислоту, последовательное восстановление и фосфорилирование которой приводит к образованию 3 - ФГК. [25]
В то же время алкилирование подобных иминов этилглоксилата схема ( 29) протекает с оптическими выходами выше 95 %, если имин образует комплекс с карбонилом железа. Как и во всех реакциях трансаминирования, ведущих свое начало от остроумной схемы, предложенной Кори, оптический индуктор не регенерируется. Асимметрия получающейся аминокислоты достигается в результате его разрушения. [26]
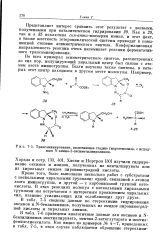 |
Трансаминирование, включающее стадию гидрогенолиза, с исходным 1Ч - амино-2 - оксиметилиндолином. [27] |
Как в 29, так и в 35 исключена еын-ак / тш-изомерия имина, и этот факт, а также жесткость гетероциклической системы приводит к повышенной степени асимметрического синтеза. Конформационная направленность реакции очень напоминает реакции ферментативного трансаминирования. [28]
Открыл ( 1937, совместно с М. Р. Крицман) реакции трансаминирования, обосновал их первостепенную роль в процессах ассимиляции и диссимиляции азота. [29]
Под трансаминированием ( переаминиро-ванием) подразумевают реакции межмолекулярного переноса аминогруппы от аминокислоты на а-кетокислоту без промежуточного образования аммиака. По меньшей мере 11 аминокислот способны вступать в реакции трансаминирования. Основными кетокислотами, принимающими участие в трансаминировании, являются пируват, ЩУК и а-кетоглутарат. Трансаминирование катализируют ферменты аминотрансферазы ( трансаминазы), которые содержатся в цитозоле и митохондриях клеток. В процессе катализа пиридоксальфосфат обратимо связывает аминогруппу, превращаясь в пиридоксаминфосфат. Схема реакции трансаминирования между глутаминовой кислотой и пируватом ( фермент - глутамат-пируват-аминотрансфераза или аланинаминотрансфераза, АлАТ): глутамат пируват - а-кетоглутарат аланин. [30]
Страницы: 1 2 3 4