Реакция - фенилизоцианат
Cтраница 1
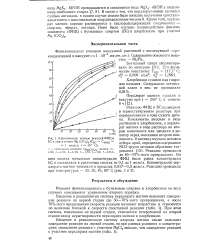 |
Кинетические кривые реакций ФИЦ и БС в присутствии Mg ( СЮ4 3 (. [1] |
Реакция фенилизоцианата с бутиловым спиртом в хлорбензоле вовсех случаях описывается уравнением второго порядка. [2]
Реакцию фенилизоцианата с исследуемым гликолем ускоряют добавками аминов или олово-органических соединений. [3]
Исследована реакция фенилизоцианата с бутиловым спиртом в хлорбензоле при участии перхлората магния. Показано, что введение в реакционную систему перхлората магния приводит к образованию комплексов его со спиртом и снижает скорость реакции. [4]
Для реакций фенилизоцианата с тиолами были вычислены величины энергии и энтропии активации при 20 и. [5]
 |
Константы скорости реакции сополимеров стирола. [6] |
При изучении реакции фенилизоцианата и двух полиэфиров ди-карбоновых кислот с различной молекулярной массой показано [8], что с более низкой скоростью реагирует полимер с большей молекулярной массой. В [9-11] также приведены данные о зависимости скорости реакции от молекулярной массы. Так, при этери-фикации сополимеров пропилена и малеинового ангидрида с молекулярными массами 42000, 51000, 91000 и 103000 установлено [9], что с повышением средней молекулярной массы скорость химической реакции уменьшается. Это наблюдается при всех температурах, однако разница между скоростями реакций для сополимеров с молекулярной массой 42000 и 103000 при 30 С вдвое больше, чем при 45 С. [7]
Данные об относительной скорости реакций фенилизоцианата с различными классами соединений, приведенные в табл. 5, не отражают всей полноты картины, так как возможно деление и внутри этих классов соединений. Так, например, первичные спирты приблизительно в три раза более реакционноспособны, чем вторичные, тогда как третичные спирты совершенно нереакционно-способны. [8]
Большое влияние на скорость реакции фенилизоцианата с этими веществами оказывает растворимость изо-цианата в реагирующем с ним соединении. [9]
По данным Хостетлера [2], реакция фенилизоцианата с - бутиловым спиртом в присутствии смешанного катализатора ( дибутил-дилауринат олова тризтиламин) протекала значительно быстрее, чем этого можно было ожидать на основании данных о скоростях этой реакции в присутствии каждого катализатора в отдельности. [10]
При более тщательном изучении катализированной амином реакции фенилизоцианата со спиртами в растворе толуола Баркас [38] в отличие от Бейкера, который проводил исследование с раствором в дибутиловом эфире, нашел, что константа скорости второго порядка не является линейной функцией концентрации триэтиламина. [11]
Так, при замене ацетонитрила на бензол в реакции фенилизоцианата с метаноло м при 20 С скорость реакции возрастает в 71 раз. Примерно такого же изменения скорости можно было ожидать при замене фенилизоцианата / г-нитрофенилизоцианатом в том случае, если бы растворитель остался прежним. [12]
В то время как зависимость второго порядка для реакции фенилизоцианата с метиловым спиртом представляет собой прямую линию, та же самая зависимость для реакции пропенилизоцианата с тем же спиртом, как - видно из рис. 4, не является прямолинейной. С другой стороны, для реакций, проведенных без катализатора, зависимость, соответствующая уравнению третьего порядка, построенная для второго члена уравнения Сато, начиная с определенного момента времени представляет собой прямую линию. По-видимому, в начальном, пер иоде реакции скорость процесса определяется в основном величиной первого члена правой части уравнения, однако по мере увеличения концентрации продукта вклад второго члена в скорость процесса становится существенным. [13]
Так, при замене ацетонитрила на бензол в реакции фенилизоцианата с метанолом при 20 С скорость реакции возрастает в 71 раз. Примерно такого же изменения скорости можно было ожидать при замене фенилизоцианата n - нитрофенилизоцианатом в том случае, если бы растворитель остался прежним. [14]
В то время как зависимость второго порядка для реакции фенилизоцианата с метиловым спиртом представляет собой прямую линию, та же самая зависимость для реакции пропенилизоцианата с тем же спиртом, как видно из рис. 4, не является прямолинейной. С другой стороны, для реакций, проведенных без катализатора, зависимость, соответствующая уравнению третьего порядка, построенная для второго члена уравнения Сато, начиная с определенного момента времени представляет собой прямую линию. По-видимому, в начальном периоде реакции скорость процесса определяется в основном величиной первого члена правой части уравнения, однако по мере увеличения концентрации продукта вклад второго члена в скорость процесса становится существенным. [15]
Страницы: 1 2 3