Реакция - фосфор
Cтраница 1
Реакция фосфора имеет большое значение при сварке под высокомарган-цотшстыми флюсами-силикатами. [1]
Как известно, реакция фосфора с кислородом при его горении в воздухе протекает бурно и эффектно, сопровождается ослепительным пламенем и большим выделением тепла. Но, как сообщает Ве-кер [2], фосфор не горит в воздухе, если компоненты реакции глубоко осушены. [2]
Хо [3] тщательно исследовали реакцию фосфора с бромом. [3]
Наиболее старым методом получения является реакция трех-хлористого фосфора с алкоголятами натрия или магния, но выходы триалкилфосфитов по этим реакциям не превышают 61 % от теоретического. [4]
Из всех вышеприведенных данных видно, что при реакции треххлори-стого фосфора на алкоголят изопропилового спирта главными продуктами реакции являются средний изопропиловый эфир фосфористой кислоты, диизопропилфосфористая кислота и средний изопропиловый эфир фосфорной кислоты. [5]
Таким образом, на основании полученных данных можно сказать, что реакция пятихлоригтого фосфора на пентаметилацетон идет в двух направлениях, причем преобладает направление, идущее в сторону образования хлоркетона. [6]
Независимо от разрабатывавших описанную методику Ченг и Хо [3] тщательно исследовали реакцию фосфора с бромом. Они рекомендуют применять для разведения трехбромистый фосфор. [7]
Красный фосфор энергично взаимодействует со щелочными металлами в жидком аммиаке с образованием фосфидов щелочного металла различной степени полимеризации в зависимости от соотношения взятых в реакцию фосфора и щелочного металла. Последующее прибавление к реакционной смеси галоидных алкилов приводит к образованию соответствующих фос-финов или полифосфинов, а при дополнительном действии на эту же реакционную смесь элементов VI группы образуются производные пятивалентного фосфора. [8]
При взаимодействии соединений ( I) с галогенсиланами, трех-хлористым фосфором, хлор-окисью фосфора триме-тилсилильный радикал легко замещается на другие остатки ( соед. Реакция трех-хлористого фосфора с N - хлоргексаметилдисила-заном не приводит к ожидаемому трихлорфосф-азотриметилсилану. Независимо от соотношения компонентов и условий проведения реакции всегда образуется трихлорфосф-азодихлорфосфор, простейший N-фосфорилиро-ванный фосфазотрихло-рид. Максимальный выход этого соединения № 8 достигается при проведении реакции с избытком трех-хлористого фосфора. [9]
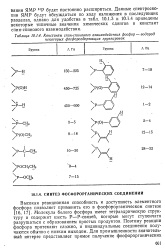 |
Константы спин-спинового взаимодействия фосфор-некоторых фосфорсодержащих группировок - водород. [10] |
Молекула белого фосфора имеет тетраэдрическую структуру и содержит шесть Р - Р - связей, которые могут ступенчато разрушаться с образованием простых продуктов. Поэтому реакции фосфора протекают сложно, и индивидуальные соединения получаются обычно с низким выходом. [11]
Значительно позже в редукторные масла, содержащие хлорные и сернистые противозадирные агенты, стали вводить соединения фосфора. При реакции фосфора с железом образуются соединения, обладающие высокой пластичностью и меньшим сопротивлением сдвигу, чем исходный металл. [12]
Соединение I за счет групп SH имеет один эквивалент кислотного числа ( при титровании до рН - 11) на один атом фосфора. Фактически продукты реакции п-ятисернистого фосфора с ароматическими экстрактами имели кислотные числа на 10 - 25 % меньше теоретических. [13]
Родий может соединяться с фосфором при температуре около 800 С. Образующиеся при этом соединения имеют различный состав в зависимости от относительных количеств взятых для реакции фосфора и металла. Каждое из соединений дает характерную рентгенограмму. Они не разлагаются при нагревании с соляной кислотой и щелочами. [14]
В открытую круглодонную колбу, хорошо охлаждаемую снаружи проточной родопроводной водой, помещают 1л врды и суспендируют в ней 100 г красного фосфора. В течение 5 ч при сильном размешивании добавляют по каплям раствор 170 г NaClC2 в 350 мл воды. Затем отфильтровывают от не вошедшего в реакцию фосфора. Добавляют 10 - 12 г активного угля и оставляют на ночь. При этом выпадают примеси, находившиеся в катионной форме. Для более полного осаждения смесь нагревают до кипения, фильтруют и ставят иа ночь в холодильник. Выделившиеся кристаллы отсасывают, промывают ледяной водой и высушивают на воздухе. Выход около 120 г. Можно вводить в реакцию и гораздо большие количества веществ, если при этом удается обеспечить достаточно интенсивное охлаждение. [15]
Страницы: 1 2