Реакция - фотовосстановление
Cтраница 1
 |
Обратимое фотохимическое восстановление хлорофилла аскорбиновой кисло. [1] |
Реакция фотовосстановления является общей реакцией для хлорофилла, его аналогов и производных. Удалось осуществить обратимое фотовосстановление хлорофилла, протохлорофилла, бактериохлорофилла и соответствующих безмагниевых производных - фео-фитинов. [2]
Эта реакция фотовосстановления будет описана в разд. В случае такого донора водорода, как С6Н5СН ( ОН) С6Н5, в концентрации 0 1 моль / дм3 квантовый выход разложения бензофенона ( фВ) близок к единице. Один этот факт исключает возможность рассмотрения возбужденного синглета бензофенона в качестве участника реакции. В то же время процессы диссипации энергии для Т протекают гораздо медленнее, чем для Si ( например, константа скорости ISC T ] W - SQ для бензофенона около 105 с -), и реакция эффективно конкурирует с другими процессами. Дальнейшее утверждение, что триплет является наиболее важной активной частицей, основано на сравнении данных по скорости, полученных именно для триплета, с полученными из рассмотрения кинетических зависимостей фв в реакции фотовосстановления для неизвестного состояния. [3]
В реакции фотовосстановления участвует триплетное состояние нитросоединения. [4]
Для урана ( VI) характерны реакции фотовосстановления. Соли уранила в растворе в присутствии разного рода восстановителей, обычно органических соединений, разлагаются под действием света, при этом происходит образование урана ( IV) и окисление органических веществ. В еще большей степени это относится к уранилперхлорату. Интересна в этом отношении также реакция с KI. Катион UCb - слабый окислитель и сам по себе неспособен в сколько-нибудь заметной степени окислять KI с образованием свободного иода, однако если раствор, содержащий TJCbSCU и КД, подвергнуть действию солнечного света, то образуются значительные количества свободного иода. Фотолиз солей уранила тесно связан с так называемым эффектом Беккереля, который у солей уранила впервые наблюдал Баур в 1908 г. Эффект заключается в том, что заряд платинового электрода, погруженного в раствор, содержащий ионы U02 и U4, принимает различные значения в зависимости от того, освещается раствор или нет. На свету потенциал электрода становится более отрицательным, чем в темноте. [5]
Это согласуется с инертностью 2-оксибензофенонов в реакции фотовосстановления ( раздел 6 - 3); можно предположить, что либо время жизни триплетных состояний этих соединений очень короткое и поэтому они не тушатся, либо триплетные состояния не образуются вовсе. [6]
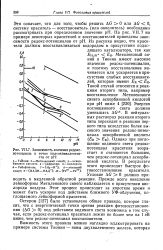 |
Зависимость значения редокс-потенциала в точке полуэквивалентности от рН. [7] |
Остером [127] было установлено общее правило, которое гласит, что с энергетической точки зрения реакция фотовосстановления ( AG 0) под действием видимого света возможна в том случае, если редокс-потенциал красителя лежит не более чем на 1 эВ ниже, чем редокс-потенциал восстановителя. [8]
Но по данным рис. 49 квантовый выход фв близок к единице при [ ВН2 ] 0 1 моль / л; следовательно, состояние не является химически активным в реакции фотовосстановления бензофенона бензгидролом. [9]
 |
Зависимость lg ( D-1 от времени для реакции фотовосстаьовления при различных концентрациях восстановителя ( С, С2 С3. [10] |
Простой метод определения qs T базируется на фотопроцессах, для которых совершенно точно доказано участие триплетных состояний. Например, таким условиям удовлетворяют реакции фотовосстановления красителей в лейкоформы. [11]
По-видимому, вследствие большего, чем в основном состоянии, значения рК ( см. раздел 4 - 6) в возбужденных синглетном и триплетном состояниях происходит отрыв протона от группы 4 - ОН и возбужденные молекулы реагируют в депротонизованной форме. Поскольку О - - сильно электронодонорная группа, очевидно, что триплет 4 - О - - бензофенона должен быть мало реакционно-способным в реакции фотовосстановления. [12]
 |
Тушение фосфоресценции диацетила донорами водорода. [13] |
Люминесценция ос-дикарбонильных соединений исследована не очень подробно, но в случае диацетила, бензила и их простых производных испускание происходит обычно из триплетного состояния 1) [35], вероятно, из п, л - состояния. Несмотря на относительно низкое значение энергии возбуждения ( ЕТ - 54 - 56 ккал / моль), а-дикарбонильные соединения легко вступают в реакции фотовосстановления - как внутримолекулярного, так и межмолекулярного. [14]
Например, фотохимическое восстановление желе-за ( Ш) до железа ( П) или ypana ( VI) до урана ( ГУ) в определенных условиях в присутствии кислорода воздуха может многократно повторяться. Железо ( П) и уран ( 1У) окисляются кислородом воздуха до железа ( Ш) и ура-на ( У1), которые могут снова вступать в реакцию фотовосстановления, окисляя при этом соответствующее количество специально подобранного реагента. Если этот реагент обладает способностью в результате окисления менять окраску ( гидразосоединения, лейкосоединения или восстановленные формы некоторых красителей), то появляется возможность определять очень малые количества железа или урана по образованию или ослаблению окраски реакционной смеси в процессе облучения. [15]
Страницы: 1 2