Реакция - восстановление - анион
Cтраница 2
Однако это преобразование уравнения Тафеля рассматривалось скорее как поправка к существующим закономерностям, пока в 1949 г., до некоторой степени случайно, Т. А. Крюкова не обнаружила удивительное явление при исследовании реакции восстановления аниона персульфата в растворах с низкой общей концентрацией ионов. Объяснение этой падающей характеристики было без труда получено при учете существования двойного слоя, отрицательные заряды металлической обкладки которого отталкивают отрицательно заряженные анионы персульфата. С этого момента влияние двойного слоя на течение электродных процессов получило общее признание и в настоящее время в ряде стран появляется большое число работ, посвященных этой проблеме. [16]
Согласно теории замедленного разряда, любые изменения состава раствора, приводящие к сдвигу г - потен-циала в положительную сторону ( добавление к раствору неактивной посторонней соли, например N32804, а также поверхностно-активных катионов или нейтральных молекул органических веществ), должны тормозить реакцию восстановления катионов и ускорять реакции восстановления анионов и нейтральных молекул. [17]
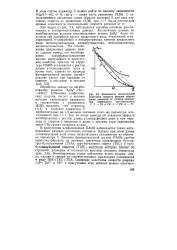 |
Зависимость относительной константы скорости реакции образования амальгам от степени заполнения поверхности трет-бутанолом. У, 2 - Zn и Cd. 3 - Pb. 4 - Tl. [18] |
Как видно из рис. 5.4, наблюдается хорошее согласие рассчитанных и экспериментальных данных. Аналогичные данные по ингибированию реакции восстановления аниона S2O82 - были получены при адсорбции кислот предельного ряда: н-масляной, - валериановой, н-капроновой и несимметричных кетонов предельного ряда: метилпропилкетона, метилбутилкетона, метиламилкетона, метилгексилкетона. [19]
 |
Сопоставление теоретических и экспериментальных кривых. [20] |
В случае восстановления анионов п отрицательно, вследствие чего зависимость силы тока от потенциала должна иметь обратный знак. При отрицательном значении Ф - потенциала реакция восстановления анионов тормозится, при положительном-ускоряется. Восстановление иона S2Og, например, тормозится анионами сульфосалицило-вой кислоты и не тормозится катионами тетрабутиламмония. [21]
Рассмотрим экспериментальные данные по влиянию ионных ПАОВ на скорость электрохимических реакций, кинетика которых определяется медленностью переноса электрона. В этом плане наиболее удобными являются реакции восстановления анионов и окисления катионов. Во-первых, влияние - потенциала на скорость этих реакций наиболее велико, поскольку эффект от изменения поверхностной концентрации реагирующей частицы суммируется с эффектом от действия i-потенциала на энергию активации. Отметим, что для реакции восстановления катионов влияние i i -потенциал а на эти два параметра электрохимических реакций направлено в противоположные стороны, и суммарный фгэффект оказывается существенно меньше. Во-вторых, для реакций восстановления анионов в присутствии органических катионов тргэффект и влияние других ингибирующих факторов ( блокировка поверхности, работа по преодолению межмолекулярных взаимодействий в адсорбционном слое и др.) оказывают противоположное действие на скорость процесса. Опять-таки в случае разряда катионов изменение - потенциала при адсорбции органических катионов в сторону менее отрицательных значений1 складывается с ингибирующими эффектами и выделить г - эффекг не представляется возможным. [22]
Так, были исследованы электростатические эффекты органических катионов тетраалкиламмония, трибензиламина и двузарядного катиона N, М - триметилен - ( триэтил) - аммония на скорость восстановления S2O -, Fe ( CN) -, PtCl -, PtClg и PtBr - на капельном ртутном электроде. Было показано, что органические катионы ускоряют реакцию восстановления анионов при потенциалах адсорбции органических катионов на ртутном электроде. [23]
Так, были исследованы электростатические эффекты органических катионов тетраалкиламмония, трибензиламина и двузарядного катиона N, Н - триметилен - ( триэтил) - аммония на скорость восстановления S2Of -, Fe ( CN) -, PtCIJ -, PtClf - и PtBr - на капельном ртутном электроде. Было показано, что органические катионы ускоряют реакцию восстановления анионов при потенциалах адсорбции органических катионов на ртутном электроде. [24]
Аналогичным образом можно объяснить и уменьшение ингибирующего эффекта катионных добавок ( катапина К. Здесь также следует считаться с изменением природы частной катодной реакции, ( заменой процесса выделения водорода реакцией восстановления анионов), а, следовательно, и с изменением механизма действия ингибиторов. [25]
С другой стороны, изменение протоно-донорных свойств ПАОВ не должно изменять эффекта их действия на скорость разряда анионов первой группы. Действительно, в растворах адамантано-вой кислоты, которая на границе ртуть / раствор образует двумерный конденсированный слой, наблюдается такое же ингибирова-ние реакции восстановления аниона S2O82 -, как и в растворе близкого ей по структуре адамантанола-1. В то же время при адсорбции адамантановой кислоты ингибирование электровосстановления аниона ВгС4 - не наблюдается, а в присутствии на поверхности электрода адамантанола-1 ток восстановления этого аниона падает до нуля. Это происходит потому, что при восстановлении анионов второй группы адамантановая кислота участвует в элементарном акте разряда в качестве донора протона. [26]
Органические катионы ускоряют реакцию восстановления анионов, а органические анионы тормозят электродный процесс. Различное действие адсорбированных органических ионов указывает на то, что их влияние связано в основном с изменением - потенциала. Влияние неорганических и органических катионов на скорость реакции восстановления аниона персульфата наблюдается только в области потенциалов их адсорбции. [27]
Рассмотрим экспериментальные данные по влиянию ионных ПАОВ на скорость электрохимических реакций, кинетика которых определяется медленностью переноса электрона. В этом плане наиболее удобными являются реакции восстановления анионов и окисления катионов. Во-первых, влияние - потенциала на скорость этих реакций наиболее велико, поскольку эффект от изменения поверхностной концентрации реагирующей частицы суммируется с эффектом от действия i-потенциала на энергию активации. Отметим, что для реакции восстановления катионов влияние i i -потенциал а на эти два параметра электрохимических реакций направлено в противоположные стороны, и суммарный фгэффект оказывается существенно меньше. Во-вторых, для реакций восстановления анионов в присутствии органических катионов тргэффект и влияние других ингибирующих факторов ( блокировка поверхности, работа по преодолению межмолекулярных взаимодействий в адсорбционном слое и др.) оказывают противоположное действие на скорость процесса. Опять-таки в случае разряда катионов изменение - потенциала при адсорбции органических катионов в сторону менее отрицательных значений1 складывается с ингибирующими эффектами и выделить г - эффекг не представляется возможным. [28]
Увеличение отрицательного заряда поверхности электрода уменьшает количество адсорбированных на нем ионов PtCl -, причем этот эффект мало зависит от общей концентрации электролита в растворе. Это и обусловливает появление минимумов на полярограммах в присутствии большого избытка фона. При восстановлении анионов S2Q2 -, Fe ( CN) g -, Hg ( CN4) 2 -, Сг ( СЫ5) з - как и при восстановлении анионов PtCl2, эффективность влияния катионов фона возрастает с увеличением их радиуса и заряда. Подобное влияние радиуса катионов фона на скорость восстановления анионов на отрицательно заряженной поверхности объясняется образованием мостиков из адсорбированного на электроде катиона и притянутого им аниона. Предположение о существенной роли подобных мостиков подтверждается низкими значениями температурного коэффициента реакции восстановления анионов S2Os - и Ре ( СМ) б - в области минимальных токов на поляризационных кривых. С повышением температуры часть мостиков на поверхности электрода разрушается, что приводит к уменьшению кажущейся энергии активации ( температурного коэффициента) реакции восстановления анионов. [29]
Увеличение отрицательного заряда поверхности электрода уменьшает количество адсорбированных на нем ионов PtCl -, причем этот эффект мало зависит от общей концентрации электролита в растворе. Это и обусловливает появление минимумов на полярограммах в присутствии большого избытка фона. При восстановлении анионов S2Q2 -, Fe ( CN) g -, Hg ( CN4) 2 -, Сг ( СЫ5) з - как и при восстановлении анионов PtCl2, эффективность влияния катионов фона возрастает с увеличением их радиуса и заряда. Подобное влияние радиуса катионов фона на скорость восстановления анионов на отрицательно заряженной поверхности объясняется образованием мостиков из адсорбированного на электроде катиона и притянутого им аниона. Предположение о существенной роли подобных мостиков подтверждается низкими значениями температурного коэффициента реакции восстановления анионов S2Os - и Ре ( СМ) б - в области минимальных токов на поляризационных кривых. С повышением температуры часть мостиков на поверхности электрода разрушается, что приводит к уменьшению кажущейся энергии активации ( температурного коэффициента) реакции восстановления анионов. [30]
Страницы: 1 2