Реакция - восстановление - двуокись - углерод
Cтраница 1
Реакции восстановления двуокиси углерода протекают через ряд стадий. [1]
Для реакции восстановления двуокиси углерода была получена следующая зависимость ( см. гл. [2]
Скорость реакции восстановления двуокиси углерода, как и всякой другой химической реакции, определяется как химической кинетикой, так и диффузией. В кислородной зоне диффузионным фактором реакции восстановления можно пренебречь, ввиду того, что эта реакция, имея своим источником появление окисла С02 непосредственно на поверхности и даже в порах угольных частиц, почти не ограничена скоростью подвода реагента. Напротив, комплекс реакций, связанных с образованием первичных окислов СО и СО, должен более или менее тормозиться диффузией кислорода из объема между частицами к реагирующей поверхности. Далее, по мере накопления С02 в объеме каналов между частицами протекает и диффузия С02 к стенкам угольных частиц. [3]
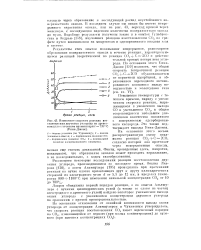 |
Изменение скорости реакции восстановления двуокиси углерода на древесном угле с течением времени при t 735 С ( Уинн-Джонс. [4] |
Рассмотрим некоторые исследования реакции восстановления двуокиси углерода, производившиеся за последнее время. [5]
В седьмой подкласс входит реакция восстановления двуокиси углерода - 19 группа. [6]
При низких температурах скорость реакции восстановления двуокиси углерода незначительна, и поэтому она в процессе газообразования почти никакого значения не имеет. Чуханов и Альтшулер предполагают, что процесс восстановления двуокиси углерода проходит через четыре этапа. [7]
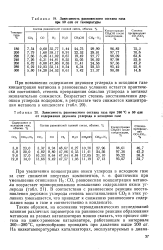 |
Зависимость равновесного состава газа при 50 am от температуры.| Зависимость равновесного состава газа при 260 С и 50 am от содержания двуокиси углерода в исходном газе. [8] |
В соответствии с равновесием реакции восстановления двуокиси углерода степень восстановления СС2 в этих условиях уменьшается, что приводит к снижению равновесного содержания воды в газе и соответственно в конденсате. [9]
Петренко [215] для изучения механизма реакции восстановления двуокиси углерода применил радиоактивный изотоп углерода Си, который вводился в ее состав. [10]
Цухановой, Викке, Геддена и других исследователей доказали большое значение внутреннего реагирования в порах угля при реакции восстановления двуокиси углерода. [11]
Очевидно, что экспериментального материала по этому вопросу еще немного, чтобы решить окончательно вопрос, каким образом окись углерода тормозит реакцию восстановления двуокиси углерода, но все же предпочтительна вторая точка зрения. [12]
Альтшулора и последующих опытов Каржавиной Чухановым [265] сделан вывод о том, что с увеличением концентрации С02 от 0 до 100 / 0 порядок реакции восстановления двуокиси углерода меняется от первого до нулевого. При малых концентрациях, согласно этому выводу, скорость реакции пропорциональна концентрации двуокиси углерода, а при больших не зависит от нее. Таким образом, имеется определенное расхождение выводов Чуханова, базирующихся в основном на опытах Каржавиной, с выводами ряда других исследователей. К тому же следует заметить, что в последующей своей работе Альтшулер [264], анализируя свои предыдущие и последующие опыты по изучению реакции восстановления углекислоты и учитывая рекомендованную в работе [270] поправку на изменение объема газа, делает уже определенный вывод о первом порядке этой реакции. [13]
 |
Зависимость равновесного состава газа при 260 С и 50 am от содержания окиси углерода в исходном газе. [14] |
С, возможна работа при давлениях ниже 100 ат, причем чем ниже температура, тем ниже может быть и давление. Влияние реакции восстановления двуокиси углерода водородом на равновесную концентрацию метанола увеличивается при повышении давления и отношения HZ: CO, а также при понижении температуры. [15]
Страницы: 1 2