Реакция - восстановление - двуокись - углерод
Cтраница 2
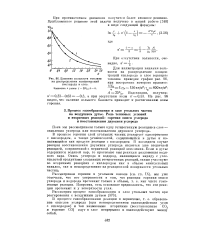 |
Влияние зольности топлива. [16] |
В процессе горения слой угольных частиц реагирует одновременно с кислородом, а также углекислотой, содержащейся в дутье и появляющейся как продукт реакции с кислородом. В последнем случае реакция восстановления двуокиси углерода является уже вторичной реакцией, сопряженной с первичной реакцией окисления. Если в дутье содержится водяной пар, то протекают еще реакции разложения водяного пара. [17]
При 100 полосы поглощения появляются и в этой области, что указывает на присутствие адсорбированной на металле окиси углерода. Кислород, образующийся при этой реакции восстановления двуокиси углерода, вероятно, диффундирует в объем металла образца. Эти последние результаты существенно отличаются от уже рассмотренных результатов Блайхолдера и Неффа. Интерпретация низкочастотных полос поглощения обсуждается ниже. [18]
Хитрин [207] наблюдал при изучении процесса горения в интервале 1100 - 1400 К своеобразное торможение скорости реагирования. Этот эффект был объяснен горением окиси углерода, а последующее увеличение скорости реагирования - возросшей ролью при этих температурах реакции восстановления двуокиси углерода. Этот эффект был обнаружен на электродном угле и антраците. [19]
Данные о них не приводим, так как они были осложнены влиянием ряда физических факторов, в частности, диффузии. Поэтому по ним трудно судить о ходе химической реакции Реакция взаимодействия углерода с водяным паром С -) - Н20 СО - f - H2 сопровождается увеличением объема газа, так же как и реакция восстановления двуокиси углерода. Федосеевым и Войковым в вышеуказанной работе это сделано для первого порядка, что не годится для рассмотренной нами реакции. [20]
Если во время реакции происходит изменение объема газа, то скорость движения газа становится функцией концентрации. В частности, реакция восстановления двуокиси углерода сопровождается увеличением объема газа. [21]
С повышением скорости газа в слое наиболее резко увеличивается коэффициент, массообмена, так как величина скорости входит в формулу ( 11) в степени, близкой к единице. В процессе горения наряду с реакцией ( 7) протекает ре - - акция ( 8) и другие сложные физико-химические процессы. В связи с более высокой энергией активации реакции ( 8) по сравнению с энергией активации реакции ( 7) при одной и той же температуре ( 1000 - 1100 С), взаимодействие углерода с кислородом протекает в диффузионной области; реакция восстановления двуокиси углерода при тех же условиях находится в области реагирования, близкой к кинетической. [22]
С повышением скорости газа в слое наиболее резко увеличивается коэффициент массообмена, так как величина скорости входит в формулу ( 11) в степени, близкой к единице. В процессе горения наряду с реакцией ( 7) протекает реакция ( 8) и другие сложные физико-химические процессы. В связи с более высокой энергией активации реакции ( 8) по сравнению с энергией активации реакции ( 7) при одной и той же температуре ( 1000 - 1100 С), взаимодействие углерода с кислородом протекает в диффузионной области; реакция восстановления двуокиси углерода при тех же условиях находится в области реагирования, близкой к кинетической. [23]
С повышением скорости газа в слое наиболее резко увеличивается коэффициент, массообмена, так как величина скорости входит в формулу ( 11) в степени, близкой к единице. В процессе горения наряду с реакцией ( 7) протекает ре - - акция ( 8) и другие сложные физико-химические процессы. В связи с более высокой энергией активации реакции ( 8) по сравнению с энергией активации реакции ( 7) при одной и той же температуре ( 1000 - 1100 С), взаимодействие углерода с кислородом протекает в диффузионной области; реакция восстановления двуокиси углерода при тех же условиях находится в области реагирования, близкой к кинетической. [24]
С повышением скорости газа в слое наиболее резко увеличивается коэффициент массообмена, так как величина скорости входит в формулу ( 12) в степени, близкой к единице. В процессе горения наряду с реакцией ( 1) протекает реакция ( 2) и другие сложные физико-химические процессы. В связи с более высокой энергией активации реакции ( 2), по сравнению с энергией активации-реакции ( 1) при одной и той же температуре ( 1000 - 1100 С), процесс взаимодействия углерода с кислородом протекает в диффузионной области, а при тех же условиях реакция восстановления двуокиси углерода находится в области реагирования, близкой к кинетической. Переход восстановительной реакции из кинетической области в диффузионную возможен при высокой температуре и небольших скоростях потока. [25]
С повышением скорости газа в слое наиболее резко увеличивается коэффициент массообмена, так как величина скорости входит в формулу ( 12) в степени, близкой к единице. В процессе горения наряду с реакцией ( 1) протекает реакция ( 2) и другие сложные физико-химические процессы. В связи с более высокой энергией активации реакции ( 2), по сравнению с энергией активации реакции ( 1) при одной и той же температуре ( 1000 - 1100 С), процесс взаимодействия углерода с кислородом протекает в диффузионной области, а при тех же условиях реакция восстановления двуокиси углерода находится в области реагирования, близкой к кинетической. Переход восстановительной реакции из кинетической области в диффузионную возможен при высокой температуре н небольших скоростях потока. [26]
Страницы: 1 2