Реакция - азот
Cтраница 1
Реакции азота в плазме требуют огромного расхода энергии на активизацию молекулы азота и ее расщепление на атомы. В отличие от этих реакций в природе существуют удивительные биологические процессы, позволяющие некоторым микроорганизмам связывать молекулярный азот в обычных, мягких условиях - без повышения температуры и давления. [1]
 |
Схема производства аммиака. [2] |
Реакция азота с водородом экзотермическая, она протекает с выделением теплоты. Поэтому для смещения равновесия в обратимой системе ( см. § 1.9) необходимо снижать температуру. Такое снижение допустимо до 450 С, при более низкой температуре скорость реакции очень мала. Равновесие в системе смещается в сторону образования аммиака при увеличении давления, поэтому процесс проводят при давлении около 30 МПа. Для увеличения скорости реакции в производстве аммиака используют катализаторы - железо с добавками оксидов алюминия и калия. [3]
При реакции азота с бором при 1500 С получают бесцветный маслянистый порошок нитрида бора BN, который выше 3000 С слегка возгоняется. Слоистая структура BN напоминает структуру графита с расстоянием между слоями 3 30 А, а между атомами В и N, образующими бесконечную сетку шестиугольных колец в слое - 1 45 А. Нитрид бора является изолятором, и предполагается, что между слоями образуются кова-лентные связи. При нагревании BN до высокой температуры при высоком давлении ( например, при 1500 С и 55 тыс. атм) получают боразон, имеющий структуру типа CuCl с плотностью 3 48 г-см-3, который тверже алмаза. Следует отметить, что связь В-N полярна и в присутствии воды нитрид бора посте пенно разлагается. [4]
Почему в реакции азота с кислородом не образуется диоксид азота или смесь монооксида и диоксида азота. [5]
Были испробованы также реакции азота с гидридами металлов и водорода с нитридами, но результаты оказались также мало удовлетворительными. [6]
Замерив объем выделившегося в реакции азота и сопоставив этот объем с навеской аминокислоты, высчитывают процентное содержание азота в веществе и через него - число аминогрупп. [7]
Мы знаем, что реакция азота с водородом протекает только при довольно высоких температурах в присутствии катализаторов и что даже при высоких давлениях образуется немного аммиака. При высоких давлениях и температурах водород диффундирует через обычные стали, азот и аммиак реагируют с ними. [8]
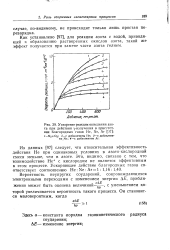 |
Ускорение реакции окисления азота при действии f - излучения в присутствии благородных газов Не, Не, Аг [ Э7 ]. [9] |
Как установлено [97], для реакции азота с водой, приводящей к образованию растворенных окислов азота, такой же эффект получается при замене части азота гелием. [10]
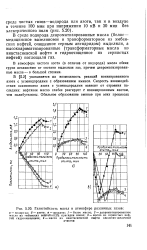 |
Газостойкость масел в атмосфере различных газов. [11] |
В [5.2] указывается на возможность реакций ионизированного азота с углеводородами с образованием аминов. Скорость взаимодействия активного азота с углеводородами зависит от строения последних: нефтяное масло слабее реагирует с ионизированным азотом, чем полибутилены. [12]
К этой группе относятся, например, реакции азота с водородом и кислородом, разложение воды. G обусловлена необходимостью активации молекулы азота в каждом акте реакции. Как будет показано в главе IV, эти реакции требуют ионизации азота и, по-видимому, хотя бы частичной диссоциации. Поэтому выход NO2 не может быть больше 2 молекул а 1 ион N2, что соответствует приблизительно 6 молекулам на 100 эв. [13]
К этой группе относятся, например, реакции азота с водородом и кислородом, разложение воды. В первом случае медленность реакции и связанная с ней малая величина G обусловлена необходимостью активации молекулы азота в каждом акте реакции. Как будет показано в главе IV, эти реакции требуют ионизации азота и, по-видимому, хотя бы частичной диссоциации. Поэтому выход NO2 не может быть больше 2 молекул а 1 ион N2, что соответствует приблизительно 6 молекулам да 100 эв. [14]
В 1962 г. Берковицем [71] при изучении реакции азота и углерода в ячейке Кнудсена с использованием масс-спектрометрического анализа было определено значение D0 ( CN) 173 ккал / моль. [15]
Страницы: 1 2 3 4