Реакция - простой эфир
Cтраница 1
Реакции простых эфиров с разрывом С-О - связей протекают в очень жестких условиях. Твердые щелочи даже при нагревании не действуют на эфиры. [1]
Реакции простых эфиров с кислородом происходят по общим закономерностям окисления органических соединений. Процесс окисления эфиров носит самоускоряющийся характер, чувствителен к добавкам веществ, образующих радикалы. Начальными продуктами окисления являются гидроперекиси, накопление которых в системе тесно связано с расходом исходного вещества и образованием различных продуктов окисления. [2]
Реакции простых эфиров с сильными минеральными кислотами протекают аналогично соответствующим реакциям спиртов. Наличие свободных электронных пар у атома кислорода обеспечивает основные свойства эфиров. [3]
Реакции простых эфиров и алканолов с минеральными кислотами, по-видимому, наиболее общий тип реакций по С - 0-связи, и реагент при этом действует не только как катализатор, но и как источник нуклеофила в виде аниона кислоты. В результате того, что кислородный атом простого эфира или алканола присоединяет протон, частично положительный атом углерода в протонированной молекуле становится гораздо более положительным и поэтому более доступным для нуклеофильной атаки. Лимитирующей стадией в первой из этих реакций служит разрыв связи С - Ос образованием карбоний-иона, который далее в зависимости от его природы может давать-продукт реакции замещения или продукт реакций перегруппировки или элиминирования. Механизм характерен для оксисоединений, в которых ОН-группа присоединена к аллильной или бензил ьной группе, содержащей электронодонорные заместители при атоме углерода, связанном с гидрок-силом, а также для третичных спиртов. Механизм характерен для первичных алканолов, за исключением алканолов вышеупомянутого типа. Вторичные алканолы реагируют по механизму, характер которого в большой степени зависит как от нуклеофильного характера аниона, так и от концентрации кислоты. Простые эфиры, по-видимому, не так подробно изучались, как алканолы, но известно, что если обе связанные с кислородом группы являются первичными, то реакция протекает по механизму SN2, в то время как третичные эфиры будут реагировать по Sjvl-механизму. [4]
Реакции простых эфиров и алканолов с минеральными кислотами, по-видимому, наиболее общий тип реакций по С - 0-связи, и реагент при этом действует не только как катализатор, но и как источник нуклеофила в виде аниона кислоты. В результате того, что кислородный атом простого эфира или алканола присоединяет протон, частично положительный атом углерода в протонированной молекуле становится гораздо более положительным и поэтому более доступным для нуклеофильной атаки. Чаще всего расщепление связи С - О происходит по SN1 - и 5 № 2-механизму. Лимитирующей стадией в первой из этих реакций служит разрыв связи С - О с образованием карбоний-иона, который далее в зависимости от его природы может давать продукт реакции замещения или продукт реакций перегруппировки или элиминирования. Механизм характерен для оксисоединений, в которых ОН-группа присоединена к аллильной или бензильной группе, содержащей электронодонорные заместители при атоме углерода, связанном с гидрок-силом, а также для третичных спиртов. Механизм характерен для первичных алканолов, за исключением алканолов вышеупомянутого типа. Вторичные алканолы реагируют по механизму, характер которого в большой степени зависит как от нуклеофильного характера аниона, так и от концентрации кислоты. Простые эфиры, по-видимому, не так подробно изучались, как алканолы, но известно, что если обе связанные с кислородом группы являются первичными, то реакция протекает по механизму SN2, в то время как третичные эфиры будут реагировать по iSjvl - механизму. [5]
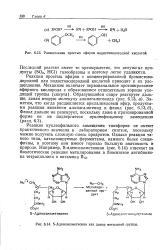 |
Расщепление простых эфиров иодистоводородной кислотой. [6] |
Реакция простых эфиров с концентрированной бромистово-дородной или иодистоводородной кислотой приводит к их расщеплению. Заметим, что когда расщепляется арилалкиловый эфир, продуктами реакции являются алкилгалогенид и фенол ( рис. 6.13 6), Фенол дальше ие реагирует, поскольку даже в протонированиой форме он не подвергается нуклеофильному замещению ( разд. [7]
Реакции алкилхлоралкиловых простых эфиров с трех-хлористым бором были изучены с такой же обстоятельностью. [8]
Реакцию простых эфиров с окисью углерода можно использовать и применительно к более сложным исходным веществам. [9]
Изучены реакции простых эфиров с алкилгипохлоритами. Установлено, что при взаимодействии алкилгипохлоритов с диалкиловы-ми эфирами при комнатной температуре ( 20 - е - 25 С) и естественном освещении в инертной атмосфере ( аргон) при эквимолярном соотношении реагентов в общем случае образуются сложные эфиры и 1 1 -ди-алкоксиалканы. [10]
При реакции галоидзамещенных простых эфиров с литийорганическими соединениями в зависимости от природы галоида и от его положения по отношению к эфирной группе возможны разные направления реакции: конденсация, отщепление НХ, обмен галоида на литий. Чем дальше от эфирной связи стоит галоид, тем более склонны галоиди-рованные эфиры к конденсации. Исходя из у-хлор -, у-бром. [11]
Из реакций простых эфиров, содержащих кратные связи, с пентахлоридом фосфора наиболее подробно изучены реакции с виниловыми эфирами. [12]
Простые эфиры фенолов расщепляются щелочами, причем легкость этого расщепления увеличивается с ростом кислотности фенола, из которого был получен исходный эфир. Действительно, многие реакции простых эфиров фенолов, обладающих ярко выраженными кислыми свойствами, протекают так же, как реакции сложных эфиров. Динитроанизол превращается в 2 4-динитрофенол уже при простом кипячении в течение часа с 1 эквив спиртового раствора едкого кали. [13]
Было показано, что природа растворителя имеет решающее влияние на течение реакции. Поэтому в сводке реакций простых эфиров фенолов с янтарным ангидридом, приводимой в табл. 29, указывается также п применявшийся растворитель. [14]
Химические превращения эпоксидов определяются тем, что в молекуле имеются полярные связи С-О и атом кислорода с неподеленными парами электронов. В принципе реакции аналогичны многим реакциям простых эфиров с нулео-фильными и электрофильными реагентами, только в случае эпоксидов эти реакции проходят очень легко. Связь С-О в эиоксидах разрывается легко, особенно в условиях кислотного катализа. [15]
Страницы: 1 2