Реакция - выделение - хлор
Cтраница 1
Реакция выделения хлора является многостадийной. Это видно хотя бы из того, что, если бы суммарный процесс протекал в одну стадию, порядок анодной реакции по хлориду был бы вторым, а катодный соответственно нулевым. [1]
В работах [102, 112] было убедительно показано, что реакция выделения хлора еа пористых графитовых анодах осуществляется в неравнодоступных условиях. Поэтому при рассмотрении механизма хлорной реакции необходимо, как указано выше, учитывать влияние пористости графитовых анодов на их кинетические характеристики. Это обстоятельство не было учтено в работах [99-101], что привело к заключению о диффузионном характере перенапряжения хлорной реакции. [2]
СрзОл - электроды проявляют сравнительно высокие активность и селективность по отношению к реакции выделения хлора. Перенапряжение этой реакции значительно меньше, чем реакции образования кислорода ( VHa 150 - 200 - мВ) В области потенциалов ( - 1 3 - 1 7В, н.в.э.), при которых осуществляются анодные реакции, у поверхности электрода существует слой пространственного заряда, обедненный по свободным носителям заряда, что свидетельствует о возможном влиянии полупроводниковой природы Co CL на электрохимические стадии анодных процессов. [3]
Со О - электроды проявляют сравнительно высокие активность и селективность по отношению к реакции выделения хлора. Перенапряжение этой реакции значительно меньше, чем реакции образования кислорода ( VHa 150 - 200 - мВ) В области потенциалов ( - 1 3 - 1 7В, н.в.э.), при которых осуществляются анодные реакции, у поверхности электрода существует слой пространственного заряда, обедненный по свободным носителям заряда, что свидетельствует о возможном влиянии полупроводниковой природы Со Ол на электрохимические стадии анодных процессов. [4]
Ср 0д - электроды проявляют сравнительно высокие активность и селективность по отношению к реакции выделения хлора. [5]
С 3 4 - электР Ды проявляют сравнительно высокие активность и селективность по отношению к реакции выделения хлора. Перенапряжение этой реакции значительно меньше, чем реакции образования кислорода ( VHa 150 - 200 - мВ) В области потенциалов ( - IS3 - I 7B, н.в.э.), при которых осуществляются анодные реакции, у поверхности электрода существует слой пространственного заряда, обедненный по свободным носителям заряда, что свидетельствует о возможном влиянии полупроводниковой природы CojOb на электрохимические стадии анодных процессов. [6]
При электролизе хлоридных растворов, как уже указано, наряду с реакциями выделения кислорода, возможно протекание реакции выделения хлора (3.7), стандартный потенциал которой ( 1 359 В) более положителен, чем реакций выделения кислорода. Исходя из этого, казалось бы, что основным процессом при электролизе должно быть выделение кислорода, но вследствие высокого кислородного перенапряжения на многих металлах в основном происходит выделение хлора. [7]
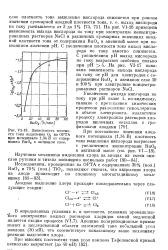 |
Зависимость плотности тока выделения 02 на ОРТА при потенциале 1 34 В от содержания Ru02 в активном слое. [8] |
Анодные поляризационные кривые имеют в исследованной области плотностей тока небольшой угол наклона ( 30 мВ), что соответствует показанному выше механизму реакции выделения хлора. [9]
Учитывая этот факт, а также роль проводящих кластеров в электронных свойствах рассматриваемых пленок, можно сделать заключение, что эти кластеры на поверхности и являются активными местами реакции выделения хлора. Поэтому в объеме поверхностного покрытия анода проводящий ЕК существует, а на поверхности находятся изолированные кластеры. [10]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки можно разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными б) ионы переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде иятиокиск, менее активна, чем рутений, присутствующий в планке двуокиси олова, главным образом, в виде двуокиси рутения. [11]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки можно разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) коны переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде пятиокиси, менее активна, чем рутений, присутствующий в плелке двуокиси олова, главным образом, в виде двуокиси рутения. [12]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки монно разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) ионы переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде дятиокиси, менее активна, чем рутений, присутствующий в плелке двуокиси олова, главным образом, в виде двуокиси рутения. [13]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки мокно разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) ионы переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде нятиокиси, менее активна, чем рутений, присутствующий в плелке двуокиси олова, главным образом, в виде двуокиси рутения. [14]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки можно разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) ионы переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде пятиокиси, менее активна, чем рутений, присутствующий в пледке двуокиси олова, главным образом, в виде двуокиси рутения. [15]
Страницы: 1 2