Реакция - выделение - хлор
Cтраница 2
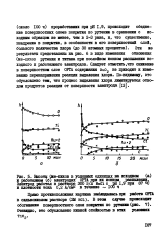
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки мозшо разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) ионы переменной валентности ( сурьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде нятиокиси, менее активна, чем рутений, присутствующий в плелке двуокиси олова, главным образом, в виде двуокиси рутения. [16]
По своему влиянию на поляризационные характеристики пленочных электродов из двуокиси олова легирующие добавки ыошго разбить на две группы: а) галоидные ионы ( хлор, фтор), уменьшающие сопротивление двуокиси олова, но являющиеся, по существу, электрохимически инертными; б) ионы переменной валентности ( сур ьма, рутений), не только увеличивающие проводимость, но значительно повышающие электрохимическую активность и селективность по отношению к реакции выделения хлора. Сурьма, которая входит в состав двуокиси олова, в основном, в виде полуторной окиси и, по-видимому, в небольших количествах в виде нятиокиси, менее активна, чем рутений, присутствующий в планке двуокиси олова, главным образом, в виде двуокиси рутения. [17]
Эти же результаты представлены на рис. 6 в виде изменения отношения Оже-пкков рутения и титана при послойном ионном распылении исходного и работавшего электродов. Следует отметить что снижение в поверхностном слое ОРТА содержания Ru02 не приводит к изменению перенапряжения реакции выделения хлора. [19]
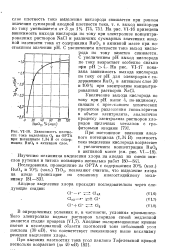 |
Зависимость плотности тока выделения 02 на ОРТА при потенциале 1 34 В от содержания Ru02 в активном слое. [20] |
Анодные поляризационные кривые имеют в исследованной области плотностей тока небольшой угол наклона ( 30 мВ), что соответствует показанному выше механизму реакции выделения хлора. [21]
Микроколбу, закрытую пробкой, в которую вставлена отводная трубка ( см. рис. 20), укрепите в штативе и конец газоотводной трубки опустите в пробирку с раствором едкого натра. Выделяющийся хлор пропускайте в охлаждаемый раствор щелочи в течение 3 - 4 мин. Если реакция выделения хлора идет слабо, микроколбу осторожно подогрейте-на маленьком пламени горелки. [22]
Влияние содержания RuO2 на электрохимические свойства композиции Fe2O3 - RuO2 имеет тот же характер, что и для ОРТА. Как показали исследования, оптимальной является активная масса, содержащая 18 % ( мол. Достоинством этого анода является его селективность в реакции выделения хлора. [23]
Показано, что расход рутения на тонну хлора и содержание кислорода в хлоре снижается с ростом плотности тока и уменьшением рН электролита. Сделан вывод о целесообразности проведения хлор-ного электролиза при максимально допустимой плотности тока и pF анолита 2 - 3 вместо 4 - 5, реализуемого в настоящее время в промышленности. Электрохимическое и коррозионное поведение ОРТА сопоставлено с поведением отдельных компонентов покрытия. Установлено, что в процессе хлорного электролиза ( рН 2) происходит значительное обеднение поверхностных слоев покрытия по рутению при неизменном перенапряжении реакции выделения хлора и внедрение в покштие большого количества хлора. В сильнокислнх растворах, наоборот, покрытие обогащается рутением. [24]
На анодах с покрытием из оксида рутения выделяется только кислород. Присутствие в анолите некоторых ионов, не участвующих непосредственно в указанных реакциях, иногда способствует их развитию. Так, ион сульфата ускоряет реакции ( 1) и ( 2) в тем большей степени, чем выше его концентрация в анолите. Скорость побочных процессов относительно скорости выделения хлора практически мала, во-первых, из-за высокого перенапряжения кислорода на графите, оксиде рутения и некоторых других анодных материалах, во-вторых, из-за низкой концентрации в анолите иона гипохлорита, хотя в стандартных условиях электродные потенциалы перечисленных побочных реакций менее электроположительны, чем потенциал выделения хлора. Так, стандартный потенциал для реакции выделения хлора равен 1 36 В, для кислорода 1 23 В, для окисления иона гипохлорита до хлората 0 51 В. [25]
Страницы: 1 2