Реакция - каталитическая гидрогенизация
Cтраница 1
Реакции каталитической гидрогенизации являются экзотермическими. В соответствии с принципом Ле-Шателье понижение температуры должно способствовать образованию спирта. Однако при низких температурах скорость гидрогенизации уменьшается. Поэтому нро-цесс ведут при 250 - 350 аС, компенсируя снижение равновесного выхода, обусловленное повышением температуры, увеличением давления. [1]
Реакции каталитической гидрогенизации жирных кислот и их эфиров обратимы, причем относительные концентрации исходных и образующихся веществ в состоянии равновесия зависят от температуры, давления водорода и других факторов. Реакции гидрогенизации являются экзотермическими. [2]
Реакции каталитической гидрогенизации кислородсодержащих органических соединений, н том числе органических кислот и их сложных эфиров, были осуществлены и изучены1 3 в период с 1897 г. по 1914 г. Фундаментальные исследования в этой области принадлежат II. Промышленная разработка процессов гидрогенизации с целью получения высших жирных спиртов относится к 1025 - 1931 гг. В это преми в Германии был выдан РЯД патентов1 11 на процессы каталитической гидрогенизации, но они носили лишь заявочный характер. [3]
Скорость реакции каталитической гидрогенизации в жидкой фазе существенно зависит от энергии связи водорода и непредельного соединения с поверхностью и их относительных адсорбционных коэффициентов. Указанные величины изменяются с природой растворителя в широких пределах, что позволяет изменить селективность процессов. [4]
Скорость реакции каталитической гидрогенизации в растворах в сильнейшей степени зависит от величины адсорбции реагирующих веществ на поверхности катализатора. При этом соотношения концентраций на поверхности в момент реакции определяются скоростями активации водорода на поверхности и скоростью его снятия непредельным соединением. В зависимости от природы растворителя меняется коэффициент распределения растворенного непредельного соединения между раствором и поверхностью катализатора. В результате этих часто противоположных влияний на поверхности катализатора устанавливается в ходе процесса известное, временное равновесие, которое определяет лимитирующую стадию реакции. Для того чтобы установить механизм реакции в данных условиях и обнаружить лимитирующую стадию реакции, требуется обычно проведение длительных кинетических опытов, в которых исследуется влияние концентрации реагирующих веществ, продуктов реакции, температуры и природы растворителя на скорость реакции. При этом все же получаются не всегда однозначные выводы. В случае необходимости могут быть приняты меры для повышения активности катализатора как за счет изменения химического состава катализатора, так и за счет изменения природы растворителя или внесения в раствор солей, кислот и оснований. [5]
Такого рода реакции каталитической гидрогенизации были открыты и изучены в начале XX века в России В. Н. Ипатьевым и во Франции Полем Сабатье. [6]
Такого рода реакции каталитической гидрогенизации былп открыты и изучены в начале XX века в России В. Н. Ипатьевым и во Франции Полем Сабатье. [7]
Ввиду особой важности реакций каталитической гидрогенизации этот отдел органического катализа аиболее разработан с практической стороны. Накоплен обширный материал, касающийся кинетики этой реакции. Однако механизм гидрогенизации далеко не выяснен. [8]
Сокольским успешно применены электрохимические методы исследования реакций каталитической гидрогенизации. Основан метод на следующем: металл, который может служить в качестве водородного электрода, в кислом растворе при насыщении водородом достигает определенного обратимого водородного потенциала. [9]
В частности, современные наукоемкие технологии на основе реакций жидкофазной каталитической гидрогенизации позволяют получать широкий спектр разнообразных полупродуктов и красителей, фото - и термостабилизаторов полимеров, каучуков, резин, добавок к моторным топливам, фармацевтических препаратов, антиоксидантов и пр. [10]
В частности, современные наукоемкие технологии на основе реакций жидкофазной каталитической гидрогенизации позволяют получать широкий спектр разнообразных полупродуктов и красителей, фото - и термостабилизаторов полимеров, каучуков, резин, добавок к моторным топливам, фармацевтических препаратов, антиоксидантов и пр. [11]
Другой, наиболее часто применяемый дегидрирующий катализатор-палладий - в реакции каталитической гидрогенизации пятичленного цикла является не таким активным, как платина. Это наблюдение было сделано Б. А. Казанским и X. Арешидзе [9], которые показали, что этилцикло-пентан при многократном контактировании с палладированным углем в избытке водорода при 300 - 310 претерпевает лишь очень незначительное изменение, гораздо более слабое, чем в присутствии платинированного угля. Однако при однократном контактировании с палладированным углем циклопентан совсем не изменил своих свойств, хотя катализатор после этого не обнаружил признаков отравления в отношении реакции дегидрогенизации циклогексана. [12]
В качестве примера можно привести широко применяющуюся на практике реакцию каталитической гидрогенизации ( или гидрирования) в жидкой фазе. Реакция гидрогенизации может осуществляться путем подачи водорода в интенсивно перемешиваемый жидкий реагент ( или в раствор реагента в жидком растворителе) в присутствии катализатора. При этом скорость реакции прямо пропорциональна концентрациям водорода и реагента в жидкой фазе. Таким образом, скорость реакции должна быть пропорциональна давлению водорода. Это и наблюдается в действительности. [13]
Вполне самостоятельный и оригинальный цикл составляют его исследования по изучению механизма и кинетики реакций избирательной каталитической гидрогенизации непредельных углеводородов. [14]
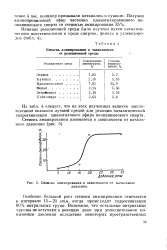 |
Степень аминирования в зависимости от начального давления. [15] |
Страницы: 1 2