Реакция - алкан
Cтраница 2
Эти реакции алканов инициируются нагреванием до высокой температуры или УФ облучением. [16]
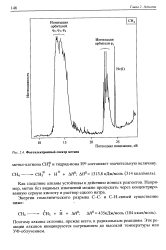 |
Фотоэлектронный спектр метана. [17] |
Эти реакции алканов инициируются нагреванием до высокой температуры или УФ-облучением. [18]
Важнейшим направлением превращений при каталитическом крекинге являются реакции алканов, которые подвергаются реакциям деструкции и изомеризации. Последовательность реакций алканов на алюмосиликатном катализаторе может быть представлена в следующем виде. [19]
В процессе тушения алкана предполагается образование неустойчивого промежуточного продукта гидрида ртути, HgH, и это, по-видимому, разумно. В реакциях алканов, сенсибилизированных Gd ( 8P1), допускается образование гидрида кадмия, CdH, потому что энергия образования GdH, равная 15 5 ккал / моль, добавленная к 87 3 ккал / моль кванта 3261 А, оказывается достаточной для разрыва связи С - Н в парафинах. [20]
Уже при рассмотрении реакций алканов отмечалось, что, если действовать кислородом на алканы СпНгп г при 100 С в присутствии солей марганца как катализатора ( берут обычно КМпС4, который восстанавливается), получается смесь кислот CmHjm iCOOH, образующихся за счет разрыва цепи вследствие окисления разных метиленовых звеньев. [21]
Изомеризация углеродного скелета алканов, как правило, происходит с большим трудом, чем изомеризация соответствуюших алке-нов, и здесь требуются очень активные кислотные катализаторы или высокие температуры. Но поразительные аналогии между реакциями алканов и алкенов заставляют думать, что и те и другие протекают через одни и те же карбониевые промежуточные продукты; основное их различие связано с трудностью образования таких карбониевых соединений из насыщенных углеводородов. [22]
Алканы служат важным исходным материалом для промышленного синтеза алкилгалогенидов. Галогенирование алканов наряду с их окислением является наиболее существенной реакцией алканов, которая приводит к самый разнообразным соединениям, используемым в качестве растворителей, анестезирующих средств, инсектицидов и бактерицидных препаратов. Поэтому синтезы алкилгалогенидов из алканов мы рассмотрим подробно. [23]
Увеличение числа углеродных атомов в молекуле олефина приводит к уменьшению энергии активации реакции образования соответствующих радикалов. Это дает возможность применения ненасыщенных углеводородов как инициаторов реакции алканов с хлором. [24]
Алканы действительно инертны по отношению ко многим реагентам, например большинству кислот и щелочей, однако всем хорошо известны экзотермические, часто идущие со взрывом реакции алканов ( бензин или природный газ) с кислородом. [25]
Следует отметить, что пропан и бутан, выходы которых равны соответственно 40 5 и 45 2 % мол. Можно принять, что С6 образуется в результате взаимодействия пропилена с пропильным карбоний-ионом. Таким образом, наиболее вероятным механизмом, ведущим к Cs и Се, является образование в ходе реакции алкана С. Действительно, в продуктах реакции обнаружено небольшое количество материала, кипящего выше гептана. Наиболее вероятно, однако, что при крекинге гептиль-ного каброний-иона образуются пропилен и бутильный кар - боний-ион или бутилен и прогшльный ион. [26]
Некоторое дальнейшее продвижение вперед связано с наличием сравнительно узкого распределения по энергиям при температуре 100 С по сравнению с 700е С. Рекомбинация метильных радикалов ограничена тем, что теплота рекомбинации метильных радикалов не больше теплоты реакции ( и энергии активации) разложения. Рекомбинация атома водорода с этильным радикалом экзо-термична на 98 ккал / молъ, что примерно на 10 ккал / молъ больше энергии, которая требуется для распада молекулы. Реакции этого типа были рассмотрены при обсуждении результатов изучения реакций алканов в разрядных трубках Вуда - Бонгофера. Однако системы эти слишком сложные и строгий анализ невозможен. [27]
Некоторое дальнейшее продвижение вперед связано с наличием сравнительно узкого распределения по энергиям при температуре 100 - С по сравнению с 700 С. Рекомбинация метильных радикалов ограничена тем. Рекомбинация атома водорода с этильным радикалом экзо-термична на 98 ккал / молъ, что примерно на 10 ккал / молъ больше энергии, которая требуется для распада молекулы. Реакции этого типа были рассмотрены при обсуждении результатов изучения реакций алканов в разрядных трубках Вуда - Бонгофера. Однако системы эти слишком сложные и строгий анализ невозможен. [28]
Сделанные выше расчеты относятся к молекуле: ССО в ее основном электронном состоянии, которое, вероятно, является три-плетным. Могут образовываться также и молекулы в синглетном состоянии. Фотолиз кетена обычно дает смесь синглетного и три-плетного метиленов. В метилене эти электронные состояния отличаются, вероятно, только приблизительно на 10 ккал / молъ, а соответствующие состояния: ССО могут отстоять друг от друга дальше. Можно утверждать, что, по аналогии с реакциями алкана, сначала образуется метиленциклопропан и что эта молекула разлагается. Значения скорости их образования указывают на высокую энергию активации, сравнимую с энергией активации других реакций разложения циклопропана. Если синглет: ССО имеет теплоту образования около 80 - 90 ккал / молъ, то при фотолизе светом соответствующей длины волны можно было бы получить энергию, достаточную для разложения промежуточного метиленциклопропана. [29]
Страницы: 1 2