Реакция - двуокись - углерод
Cтраница 1
Реакция двуокиси углерода с твердым углеродом тормозится окисью углерода. Скорость этой реакции описывается сложным кинетическим уравнением. [2]
Наиболее тщательное исследование реакции двуокиси углерода с перекисью бария проведено Аскенази и Розе [5], которые суммируют также работы предыдущих авторов и приводят полную библиографию по этому вопросу. [3]
Кроме того, скорость реакции двуокиси углерода с карбонатами весьма мала, что приводит к увеличению циркуляции раствора, возрастанию габаритов аппаратуры и расхода пара на регенерацию поташных растворов. [4]
Реакция серо-окиси углерода с моноэтаноламином аналогична реакции двуокиси углерода, но при температуре очистки газа протекает значительно быстрее. При комнатной температуре сероокись углерода почти полностью и необратимо взаимодействует с моноэтаноламином, образуя оксазолидон-2. Сероокись углерода реагирует и с диэтаноламином, но значительно медленнее. Более того, при регенерации раствора продукт реакции сероокиси углерода с диэтаноламином диссоциирует, выделяя амин. Поэтому в тех случаях, когда в газовом потоке присутствует сероокись углерода, предпочтительнее применять растворы диэтаноламина вместо моноэтаноламина. Третичные амины, такие как триэтаноламин и метилдиэтаноламин, не реагируют с сероокисью углерода. [5]
Пока же мы можем констатировать, что нам неизвестна ни одна реакция двуокиси углерода или карбоксила in vitro, которую можно было бы назвать обратимым ( или почти обратимым) восстановлением двойной связи С О до одинарной связи ОН-ОН. Исследование возможностей такого восстановления очень важно для изучения искусственного фотосинтеза. [6]
 |
Равновесие. С02 СН ЦТ 2СО 2Я2. [7] |
Возможность получения спиртов, альдегидов, кетонов и сложных эфиров путем реакции двуокиси углерода с углеводородами обсуждается в гл. [8]
Как видно из табл. 10, заметного изменения отношения СО / ССЬ и понижения скорости реакции пропорционально добавленной двуокиси углерода обнаружено не было. [9]
Отсюда следует, что окисление хрома или хромистых сталей с пленками из Сг2О3 в основном зависит от образующейся в процессе реакции двуокиси углерода. Это указывает на то, что атмосфера из СО - СО2 - N непригодна для безокислительного нагрева высокохромистых сталей. [10]
При изучении процесса парофазного окислительного аммонолиза хинолина, изохинолина и алкилпири-динов для контроля процесса необходимы данные об образовании в процессе реакции двуокиси углерода и возможности образования водорода. [11]
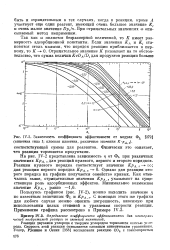
На рис. 132 проводится сравнение результатов измерения величин & з [ С ( ], полученных на рис. 126, с данными для реакции двуокиси углерода. На основании этого можно сделать вывод, что число активных центров будет больше в том случае, если в газовой фазе присутствуют пары воды. Поскольку скорость реакции не зависит от размеров частиц и концентрации инертного газа, можно предположить, что эта разница обусловлена наличием активных центров различного типа. С другой стороны, трудно объяснить это отсутствием равновесия, поскольку влияние диффузионного замедления не подтверждается зависимостью скоростей от размеров частиц. [12]
Определение окиси углерода в воздухе основано па непрерывном отборе проб исследуемого воздуха, окислении окиси углерода пятиокисью иода при 100 - 140, дальнейшем поглощении образовавшейся во время реакции двуокиси углерода раствором NaOH и измерении изменения электропроводности раствора при непрерывном протекании его через электролитическую ячейку. [13]
Определение окиси углерода в воздухе основано на непрерывном отборе проб исследуемого воздуха, окислении окиси углерода пятиокисью иода при 100 - 140, дальнейшем поглощении образовавшейся во время реакции двуокиси углерода раствором NaOH и измерении изменения электропроводности раствора при непрерывном протекании его через электролитическую ячейку. [14]
Двуокись углерода, образующаяся в результате реакций цитрат-ного цикла в тканях, до некоторой степени растворяется в плазме крови и проникает в эритроциты. В них карбоангидратаза катализирует реакцию двуокиси углерода с водой, в результате которой образуется угольная кислота. Когда концентрация угольной кислоты в эритроцитах увеличивается, начинается реакция угольной кислоты с калиевой солью гемоглобина. [15]
Страницы: 1 2