Реакция - двуокись - углерод
Cтраница 2
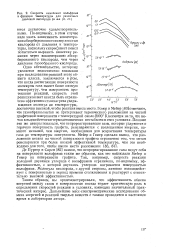 |
Скорость окисления вольфрама. [16] |
Де Пуртер и Сирей [85] нашли, что непрореагировавшие газы ведут себя на поверхности вольфрама таким же образом, как это наблюдали Мейер и Гомер на поверхности графита. Так, например, скорость реакции холодной двуокиси углерода с вольфрамом ограничена, по-видимому, эффективностью, с которой двуокись углерода нагревается поверхностью вольфрама. Молекула кислорода, с другой стороны, активно взаимодействует с поверхностью в период времени столкновения и реагирует с относительно высокой эффективностью. [17]
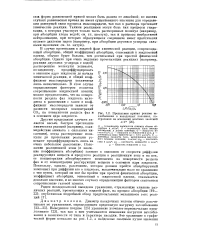 |
Предельная кривая режима захлебывания в насадочных колоннах, построенная на основании опытных значений A / F. [18] |
В случае протекания в жидкой фазе химической реакции, сопровождающей абсорбцию, общий коэффициент абсорбции, отнесенный к жидкостной пленке, обычно будет больше, чем достигаемый при простой физической абсорбции. Однако при очень медленно протекающих реакциях ( например, реакция двуокиси углерода с водой) растворенные молекулы успевают, по-видимому, продиффундировать в основное ядро жидкости до начала химической реакции, и общий коэффициент массопередачи увеличится лишь незначительно. В этом случае определяющим фактором является сопротивление жидкостной пленки; можно предположить, что на поверхности раздела фаз жидкость находится в равновесии с газом и коэффициент массопередачи зависит от разности молярных концентраций СО 2 на поверхности раздела фаз и в основном ядре жидкости. [19]
Фенолят лития распадается при 450 на жидкие продукты и водород, метан, окись углерода и двуокись углерода. Основной фенолят кальция, НО - Са - ОС6Н5, ведет себя аналогично, но в продуктах реакции двуокиси углерода не имеется. Если последнюю реакцию проводить ( при 450) в струе углекислого газа, то реакция полностью протекает с образованием фенола и углекислого кальция. Фишер и Эрхардт отмечают фенол как главный продукт пирогенетического разложения фенолята кальция, Са ( ОС6Н5) 2, но Нидерхаузерн173 еще раньше отмечал образование дифенилового эфира и окиси дифенилена. При слабо красном калении фенолят алюминия172 образует водород, метан и жидкие продукты, которые содержат бензол, фенол, дифениловый эфир и ксантен. Гладстон и Трайб17 нашли, что при сухой перегонке фенолята алюминия можно получить 30 - 35 % дифенилового эфира. [20]
Нагревание платиновой проволоки ( диаметр 0 3 мм) производят током, получаемым от аккумулятора на 4 в; емкость аккумулятора должна быть не менее 40 а-ч. После сжигания метана, газовую смесь пропускают в специальную пипетку с водным раствором КОН для - поглощения образующейся во время реакции двуокиси углерода. [21]
Метиловый спирт через подогреватель попадает в реактор, где смешивается с окисью углерода. Реакционная смесь охлаждается в холодильнике, причем большая часть образующейся при реакции двуокиси углерода растворяется в уксусной кислоте. [22]
Типичное применение теории химической абсорбции основано на использовании данных о скорости массопередачи для оценки констант скорости довольно быстрых реакций. Это представляет особый интерес в катализируемых реакциях. Случаи такого типа могут быть найдены в серии статей Данквертса с сотрудниками [9-11] по каталитическому действию различных веществ на реакцию двуокиси углерода с водой. Скорость последней может увеличиваться под действием катализаторов, так что реакция становится конкурентной с прямой реакцией между СО2 и ОН - даже при довольно высоких значениях рН, таких, например, какие наблюдаются в буферных растворах. [23]
Возможно и другое объяснение различий в величинах ks [ Ct, основанное на роли СО, диффундирующей из пористых частиц кокса. Поскольку основным продуктом реакции кокса с СОа является окись углерода и выход ее для эквимолярных количеств выше при использовании СО. При таких условиях величины & з [ С ( ] будут иметь смысл как некоторые эффективные значения, более низкие для реакции двуокиси углерода. Это объяснение подтверждается отклонением значений k3 [ Ci ] от графика Аррениуса ( рис, 123 и 132); но оно противоречит тому факту, что прямые для реакций кокса с ССЬ и НаО практически параллельны. Это обстоятельство подтверждает первую гипотезу. Действительно, удельный объем кокса зависит от степени измельчения. Эта зависимость обусловлена деструкцией макропор при уменьшении размеров частиц и согласуется с наличием распределения пор по диаметрам. Удельный объем уменьшается от 1 08 ( это соответствует плотности 0 923 г / см3) до 0 628 ( плотность 1 59 г / см3) при уменьшении размеров частиц от 8 - 6 до 100 - 140 меш. Анализ кривой показывает, что крупные поры диаметром 120 - 420 мк составляют 78 % общего объема пор кокса, измельченного до размера 8 - 16 меш. Поскольку размер частиц кокса, используемого в данной работе, изменялся в широком диапазоне: от 8 - 16 до 140 - 200 меш, то крупные поры могли снять любой эффект, обусловленный размерами частиц. Поэтому на основании представленных в настоящей работе результатов не следует делать вывод, что размеры частиц менее 0 1 мм или более 2 мм вообще не оказывают влияния на протекающие химические процессы. [24]
После продувки к системе присоединяются взвешенные поглотительные трубки Т и U через ловушку R, как показано на фиг. Трубка Т содержит безводный перхлорат магния и пятиокись фосфора в виде слоев, разделенных асбестом. Для поглощения тепла, выделяющегося при реакции двуокиси углерода с аскаритом, трубку U погружают в стакан с охлажденной дистиллированной водой. Продолжая продувать кислород со скоростью 250 лл / мин. После того как сожжение началось, что определяется по конденсации воды в трубке ловушки R, выступающая часть трубки для сожжения М между печами покрывается соответствующей формы теплоизолирующими блоками из окиси магния. [25]
Изучение началось с гидридов, которые реагируют с водой с образованием водорода. Однако литийалюминийгидрид очень неустойчив в вакууме; даже после продолжительной эвакуации для удаления примесей были получены высокие и непостоянные результаты холостых опытов. Кроме того, было показано, что после сожжения органических образцов реакции двуокиси углерода или воды с гидридом при - 102 ( баня спирт - азот) не наблюдалось; взаимодействие воды с гидридом при комнатной температуре [2] также не дает количественных результатов. Разнообразные опыты [5, 6] были проведены с гидридом кальция - более устойчивым в вакууме, чем литийалюминийгидрид; он не вступал в заметное взаимодействие с двуокисью углерода, водой или кислородом при - 102 и с двуокисью углерода или кислородом при комнатной температуре. Результаты взаимодействия воды с гидридом кальция при комнатной температуре, по-видимому, были близки к количественным ( за исключением органических или неорганических веществ, содержащих около 3 - 6 мкг водорода) при условии, что гидрид кальция свежий; однако последующие определения давали заниженные результаты, а холостые опыты - высокие величины; для получения первоначальных значений холостых определений была необходима продолжительная эвакуация. [26]
Накопление Са ( ОН) 2 нежелательно, вследствие его тенденции удерживать воду. При 2 - 3 анализах влияние такого удерживания незначительно. При большом числе анализов патроны с карбидом кальция заменяются через каждые три опыта. Если свежий патрон не использовался более получаса, его заменяют новым; свежий патрон продувается полчаса. Заметных ошибок в результате реакции двуокиси углерода с небольшими количествами образующейся гидроокиси кальция не было обнаружено. [27]
Применение спирали из медной сетки также нежелательно, ибо примесь цинка и свинца в меди может восстанавливать двуокись углерода до окиси углерода. Кислород, поступающий для сжигания топлива, должен быть очищен от двуокиси углерода и воды. Двуокись углерода улавливают натронной известью Ca ( OH) 2 - NaOH и раствором едкого кали. Проходя через натронную известь, кислород увлажняется водой, выделяющейся при реакции двуокиси углерода с натронной известью, а проходя через раствор КОН, увлажняется водой, содержащейся в растворе. Поэтому в очистительной цепи поглотители двуокиси углерода должны предшествовать поглотителям влаги. [28]
Страницы: 1 2