Значение - стационарный потенциал
Cтраница 1
Значение стационарного потенциала на трубопроводах определяют в периоды отсутствия тяговых нагрузок на рельсовой сети электрифицированного транспорта. [1]
Значение стационарного потенциала в 0 5 М H2SO4 при давлении Ра0г98 кПа составляет на пиро-графите - 0 65 В и на активированном угле - 0 35 - 0 40 В. Посадка на углеродные материалы кислых оксидов приводит к снижению скорости реакции. [2]
Значение стационарного потенциала зависит от концентрации кислорода. Коррозионное растрескивание происходит в том случае, когда стационарный потенциал более положителен, нежели потенциал пробоя. [3]
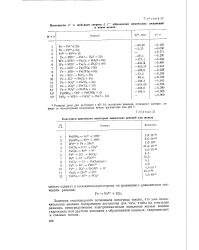 |
Константы равновесия некоторых химических реакций для железа. [4] |
Значение стационарного потенциала электрода таково, что уже незначительная анодная поляризация достаточна для того, чтобы на электроде началось непосредственное электрохимическое окисление железа ионами гидроксила или другими анионами с образованием окисных, гидроокисных и солевых пленок. [5]
Значение стационарного потенциала углеродистых и низколегированных сталей в грунте по отношению к мед-носульфатному электроду сравнения примерно одинаково HSjB. В зависимости о т состояния изоляционных покрытий, состава и влажности грунтов эта величина может колебаться на 0 2 В. [6]
Сравнение значений стационарных потенциалов железа ( потенциалов коррозии) в нейтральных электролитах ( - 0 3 - - 0 4 В) со значениями потенциалов образования окислов железа приводит к выводу, что уже при незначительном смещении потенциала железа или стали в положительную сторону от стационарного параллельно процессу ионизации металла на электроде должна протекать реакция окисления, приводящая к возникновению на поверхности окисных слоев. [7]
По значениям стационарных потенциалов железа в растворах РеС12 и в растворе NaCl ( спокойном, с перемешиванием и с добавкой Н2О2) определяют контролирующий фактор коррозии железа. Для этого рассчитывают по формулам ( 69) и ( 70) степень анодного и катодного контроля. В указанных формулах Vx - измеренное стационарное значение потенциала железа в РеС12 и NaCl; ( У обр оЛбр ( так как КОРРОЗИЯ в исследуемых растворах протекает в основном с кислородной деполяризацией) и рассчитывается по формуле ( 71); У. [8]
Если сравнить значения стационарных потенциалов железа в нейтральных электролитах ( - 0 3 - - 0 5 в) со значениями потенциалов образования окисных слоев, то легко прийти к заключению, что уже при незначительном смещении потенциала от стационарного наряду с процессом ионизации происходит реакция электрохимического окисления. По мере смещения потенциала в положительную сторону процесс окисления все более усиливается, и при достижении потенциала пассивации электрод уже в значительной степени покрывается окисным слоем, приводящим к резкому уменьшению скорости ионизации металла; наступает явление пассивности. [9]
Титан по значению стационарного потенциала близок к таким металлам, как серебро, нержавеющая сталь и монель-металл. [10]
Титан по значению стационарного потенциала близок к таким металлам, как серебро, нержавеющая сталь и монель-металл. Стационарный потенциал титана в морской воде равен 0 15 в по отношению. [11]
 |
Стационарные потенциалы электродов в растворе Ш N2H4 6 M КОН при 20 С. [12] |
Различие в значениях стационарных потенциалов указывает на то, что характер взаимодействия металла с гидразином во многом определяется химической природой электрода-катализатора. Данные табл. 12 свидетельствуют также о том, что значение потенциала в растворе гидразина для одного и того же металла в сильной степени определяется состоянием его поверхности. Сравнение потенциалов черней и гладких металлов показывает, что потенциалы черней в растворе гидразина более отрицательны, чем потенциалы гладких металлов. [13]
В работе определены значения стационарных потенциалов низко - и средне-углеродистой стали; сняты поляризационные кривые в смесях H2SO4 и НС1 без ингибиторов и с добавками И-1-В и катапина. [14]
В обоих случаях значения стационарного потенциала и потенциала при постоянной величине тока линейно изменяются при изменении рН с наклоном - 0 06 В. Предполагается, что таллий и свинец присутствуют на поверхности платины в виде адатомов и дестабилизируют оксидную пленку, тормозящую восстановление кислорода. [15]
Страницы: 1 2 3 4