Значение - стационарный потенциал
Cтраница 2
В табл. 1 приведены значения стационарных потенциалов медь - и железосодержащих минералов в различных электролитах. При этом минералы сгруппированы по следующим признакам: к первой группе отнесены минералы, содержащие однозарядную медь халькозин Cu2S и куприт - Cti2O, ко второй - ковеллин CuS и те-норит СиО, в которых медь двухзарядна. [16]
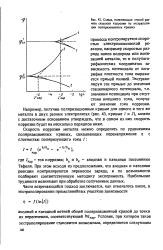 |
Схема, поясняющая способ расчета скорости коррозии по экстраполяции поляризованных. кривых. [17] |
Экстраполируя эти прямые до значения стационарного потенциала, т.е. значения потенциала при отсутствии внешнего тока, получают значение тока коррозии. [18]
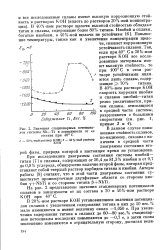 |
Значения стационарных потенциалов системы Nb-Ti в зависимости от ее. [19] |
На рис. 2 представлены значения стационарных потенциалов сплавов в зависимости от их состава в 20 и 40 % - ном растворе КОН при 40 С. [20]
Это равенство позволяет найти значение стационарного потенциала корродирующего металла и скорости коррозии. [21]
 |
Потенциостатическая кривая, характеризующая поведение металлов в щелях. АБВГД - кривая анодной поляризации KI, Кг, К, - катодные поляризационные кривые для открытой поверхности. [22] |
При этом в зависимости от значения стационарного потенциала следует различать, в свою очередь, два случая: 1) стационарный потенциал металла находится вблизи потенциала полной пассивации и 2) потенциал значительно от него удален. [23]
На реализацию этой термодинамической возможности указывают значения стационарных потенциалов сталей более отрицательные, чем обратимые потенциалы выделения водорода. В противном случае [ при срст ( рн / Н2) 06р ] термодинамическая возможность коррозии с выделением водорода не реализуется в данных условиях. [24]
На реализацию этой термодинамической возможности указывают значения стационарных потенциалов сталей более отрицательные, чем обратимые потенциалы выделения водорода. В противном случае [ при срст ( рн / Н2) 06р ] термодинамическая возможность коррозии с выделением водорода не реализуется в данных условиях. [25]
В неаэрируемых растворах этих же концентраций значения стационарного потенциала стали ОХ21Н5Т соответственно равны 40 мв и - 140 мв, а анодная поляризуемость хромо-никелевой стали в растворах, через которые пропускается азот, сильно затрудняется при добавлении в раствор муравьиной, кислоты. [26]
В зависимости от характера анодных кривых и значения стационарного потенциала будут интенсивно растворяться или обедненные границы твердого раствора, что, вероятно, в условиях, когда не достигнут их потенциал пассивации, в то время как структурные составляющие будут находиться в пассивном состоянии, или наоборот, наиболее интенсивно будут растворяться структурные составляющие. [27]
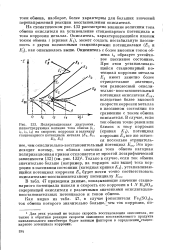 |
Поляризационная диаграмма, иллюстрирующая влияние тока обмена ( ii, J2, 13, ii на скорость коррозии и величину стационарного потенциала металла ( Е, Ег, Ез, Et. [28] |
В табл. 47 приведены данные, показывающие значение стационарного потенциала никеля и скорость его коррозии в 1 N H2S04, содержащей окислители с различными значениями окислительно-восстановительных потенциалов и токов обмена. [29]
Смещение потенциала стали в отрицательную сторону от значения собственного стационарного потенциала при наложении внешнего катодного тока определяет защиту металла подземного трубопровода. Когда катодная поляризация ( перенапряжение) возникает на металле при прохождении наложенного внешнего тока, растворение или ток коррозии уменьшается, в то время как скорость восстановления увеличивается. На закономерном снижении скорости растворения металлов по мере смещения их электродных потенциалов в отрицательном направлении в области потенциалов более отрицательных, чем стационарный потенциал, основан метод катодной защиты металлов от коррозии. [30]
Страницы: 1 2 3 4