Значение - равновесный потенциал
Cтраница 1
 |
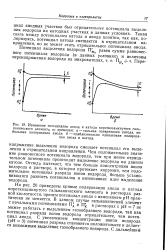
Графическое изображение вольта-потенциала в процессе окислительно-восстановительной реакции. [1] |
Значения равновесного потенциала практически для всех металлов известны, поэтому не представляет особого труда найти работу на границе раздела фаз металл-раствор. [2]
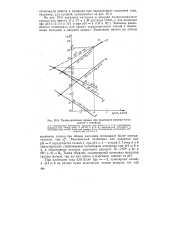 |
Поляризационные кривые при раздельном разряде ионов никеля и водорода. [3] |
Значение равновесного потенциала для никеля характеризуется точкой 3 пересечения катодной и анодной кривых. [4]
Значение равновесного потенциала электрода, при котором составляющие электролита, участвующие в электродной реакции, находятся в стандартном состоянии: растворенные - в нормальной концентрации, твердые - в чистом состоянии, газообразные - при атмосферном давлении. Практически обычно считают, что каждый газ, входящий в состав газовой фазы, является совершенным газом и его летучесть определяется парциальным давлением. [5]
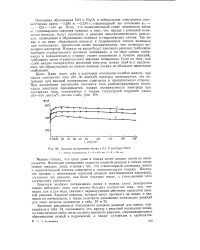 |
Анодная поляризация цинка в 0 1 N растворе NaCl. [6] |
Значения равновесных потенциалов анодных реакций для цинка, приведенные в табл. 24, показывают, что, наряду с реакцией ионизации цинка, на этом металле очень легко должны протекать реакции, сопровождающиеся образованием окисей и гидроокисей, а также сульфидов и карбонатов. [7]
Благодаря высокому электроположительному значению равновесного потенциала этой реакции и малой концентрации растворенного кислорода в электролите при потенциале медного электрода она протекает на предельном токе диффузии. Наличие реакции катодного восстановления кислорода приводит в отсутствие внешней поляризации к установлению стационарного потенциала фст, значение которого незначительно положительнее рр. При стационарном потенциале происходит, хотя и небольшое, растворение меди. Роль растворенного кислорода этим не ограничивается. Он может еще окислять до Си2 ионы Си, уходящие от поверхности анода при анодной поляризации, благодаря чему реакция образования порошка меди протекает с меньшей скоростью. [8]
Чем положительнее значение равновесного потенциала водорода, тем при менее отрицательном потенциале происходит выделение водорода на данном катоде. [10]
В случае когда значения равновесных потенциалов двух металлов заметно отличаются, но катодная поляризация одного из них ( более электроотрицательного) меньше, чем поляризация другого ( менее электроотрицательного), то совместное осаждение металлов в данном случае возможно при увеличении плотности тока. По мере повышения плотности тока возрастает содержание более электроотрицательного металла в сплаве. [11]
Вообще вблизи от значения равновесного потенциала преобладает рост кристаллов с ограниченным числом зародышей: при высокой поляризации обычно число зародышей велико, а поэтому рост кристаллов невелик. На этом Основании при слабой поляризации металлы кристаллизуются из электролита всегда в грубокристаллической форме, а при большой поляризации, напротив, в мелкокристаллической форме. [12]
Этот ряд металлов делится значениями равновесных потенциалов водородного ( - 0 414 и 0 000 в) и кислородного электродов ( 0 815 и 1 23 в) для значений рН, соответственно равных семи ( нейтральные растворы) и нулю ( кислые растворы), на пять групп, характерных по своей термодинамической стабильности. [13]
При катодной поляризации может быть достигнуто значение равновесного потенциала наиболее активной составляющей, при этом будет наблюдаться катодная защита сплавов подобно тому, как это рассмотрено на фиг. Защита от экстрагивной коррозии может быть также достигнута установлением такого окислительно-восстановительного потенциала раствора, при котором все компоненты сплава будут находиться в пассивном состоянии. Для достижения этих условий существенное значение имеет рН раствора. [14]
Стационарный потенциал кислородного электрода обычно отрицательнее значения равновесного потенциала. Разница между значениями этих потенциалов составляет 0 1 - 0 4 В. Трудности достижения равновесного потенциала могут быть обусловлены протеканием наряду с восстановлением кислорода до воды и других процессов: окисление примесей и восстановление кислорода до пероксида водорода. [15]
Страницы: 1 2 3 4