Любая электродная реакция
Cтраница 1
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и поэтому все электроды являются окислительно-восстановительными. [1]
Любая электродная реакция связана о изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. [2]
Любая электродная реакция связана с переносом заряда через границу раздела. Долгое время господствовало представление о том, что сам по себе перенос заряда, например разряд иона, является чрезвычайно быстрым, и измеряемая скорость реакции в целом определяется другими стадиями процесса, например последующими химическими реакциями незаряженных частиц. [3]
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. [4]
Любая электродная реакция в принципе представляет собой окислительно-восстановительную реакцию. Однако к окислительно-восстановительным ( редокси -) электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. [5]
Любая электродная реакция в принципе представляет собой окислительно-восстановительную реакцию. Однако к окислительно-восстановительным ( редокси -) электродам относят только те электроды, в реакциях которых не принимают непосредственного участия металлы и газы. Такие электроды состоят из металлического проводника, контактирующего с раствором, содержащим окислители и восстановители. К металлу в редокси-электродах предъявляются те же требования, что и к металлическому проводнику в газовых электродах. [6]
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ и в этом смысле все электроды представляют собой редокси-системы. [7]
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-системы. Однако термин окислительно-восстановительные или редокси-электроды употребляется обычно в тех случаях, когда в электродной реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов. [8]
Любая электродная реакция связана с изменением окислительно-восстановительного состояния участвующих в ней веществ, и в этом смысле все электроды представляют собой редокси-систе-мы. Однако термин окислительно-восстановительные, или редокси-электроды, употребляется обычно только в тех случаях, когда в электродной реакции не участвуют непосредственно металлы или газы. Металл в редокси-электроде, обмениваясь электронами с участниками окислительно-восстановительной реакции, принимает потенциал, отвечающий установившемуся редокси-равновесию. К металлическому проводнику предъявляются здесь те же требования, что и в случае газовых электродов. [9]
Уравнения (3.37) и (3.38) могут описывать скорость любой электродной реакции, а не только рассмотренного процесса окисления - восстановления. [10]
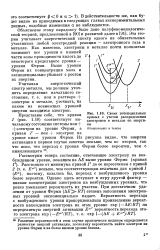 |
Схема потенциальных кривых с учетом распределения электронов в металле по энергиям. [11] |
Эта теория учитывает энергетический спектр одного из обязательных участников любой электродной реакции - электронного газа в металле. Как известно, электроны в металле почти полностью занимают все уровни в нижней части зоны проводимости вплоть до некоторого предельного уровня - уровня Ферми. Выше уровня Ферми их концентрация мала и экспоненциально убывает с ростом их энергии. [12]
В последнее время особое внимание проявляется к проблемам электрохимической кинетики, которые являются центральными при осуществлении любых электродных реакций. Теоретические обобщения и выводы электрохимической кинетики все более широко применяются не только при изучении теоретических закономерностей электрохимии, но и в электрохимической технологии. Результаты теоретических исследований позволяют, в частности, глубже осознать связь между явлениями, которые протекают при возникновении двойного электрического слоя на границе фаз, и теми глубокими изменениями вещества, которые наблюдаются на электродах при пропускании тока. [13]
Дополнительным следствием является то, что, если известны окислительные потенциалы ряда электродных реакций, можно определить благоприятное направление для любой комбинации. Любая электродная реакция в ряду может быть обратной для любой другой электродной реакции с более низким окислительным потенциалом. Однако следует иметь в виду, что многие реакции, неблагоприятные с точки зрения потенциалов для стандартных состояний, можно осуществить при изменении рН или других концентрациях. [14]
Любая электродная реакция протекает только параллельно со второй, сопряженной реакцией. Из-за искажающего влияния этой реакции ( в том числе из-за тепловых, диффузионных и других потоков в электролите) невозможно определить экспериментально энергетические эффекты и, следовательно термодинамические параметры отдельной электродной реакции. Эти параметры не могут быть и рассчитаны, так как для этого требуется знание электрохимических потенциалов отдельных ионов и гальвани-потенциала на границе электрод / электролит. [15]
Страницы: 1 2