Любая электродная реакция
Cтраница 2
 |
Процессы, происходящие в электрохимическом элементе. [16] |
Важное значение такого перечня реакций вполне очевидно. Для любой электродной реакции можно подобрать обратную реакцию ( число отданных электронов должно быть равно числу полученных электронов), в результате чего будет происходить нужная химическая реакция. Перечень реакций позволяет нам предсказать, в какую сторону будет смещаться равновесие - в сторону исходных веществ или в сторону образования продуктов реакции. Поэтому было бы желательно расширить этот перечень и придать ему более количественный характер. [17]
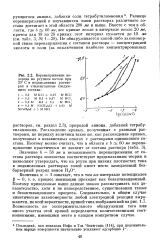 |
Перенапряжение водорода на ртутном катоде при 20 С в подкисленных растворах в этиленгликоле следующего состава. [18] |
Поэтому приведенные выше данные можно рассматривать как доказательство, хотя и не непосредственное, существования также и безактивационного процесса. Следовательно, в общем случае кинетические закономерности любой электродной реакции выражаются, по всей вероятности, кривой типа изображенной на рис. 1.7. Возможность же экспериментального обнаружения того или иного участка этой кривой определяется количественными соотношениями, имеющими место в каждом конкретном случае. [19]
Сначала через ячейку проходит небольшой ток, называемый остаточным. Другая часть остаточного тока ( фарадеевский ток) расходуется на электролитические процессы, такие, как окисление или восстановление следов примесей. Затем ток начинает экспоненциально возрастать вследствие протекания основной электролитической реакции. Это происходит после того, как потенциал электрода превысит значение равновесного потенциала данной электродной реакции. Для протекания любой электродной реакции необходимо более или менее значительное перенапряжение ( см.), тем большее, чем больше ток через систему. [20]
До сих пор в ходе изложения предполагалось, что на каждом электроде происходит только один процесс, однако во многих случаях на электроде идут одновременно две или большее число реакций. Так, например, при электролизе солей никеля отложение металла почти всегда сопровождается выделением некоторого количества водорода. При прохождении тока через раствор соли четырехвалентного олова на катоде может происходить одновременно восстановление ионов Sir1 144 в Sir14, отложение олова и выделение водорода. Аналогичным образом при электролизе разбавленной соляной кислоты на аноде выделяется смесь кислорода и хлора. Условия, при которых возможно одновременное протекание двух или большего числа электродных процессов, будут рассмотрены в последующих главах; пока же следует отметить, что при одновременном протекании нескольких реакций общее количество эквивалентов, выделившихся и Ж в ссТаТяоМ е ных а к л од а-такг же растворившихся или окисленных на аноде, всегда равно тому количеству, которого требуют законы Фарадея. Отношение количества выделившегося вещества к теоретически вычисленному или, в общем случае, отношение действительного количества продуктов любой электродной реакции к теоретически вычисленному количеству называется выходом по току соответствующей реакции. [21]
Страницы: 1 2