Кислородная реакция
Cтраница 1
Кислородные реакции наблюдаются при потенциалах, при которых поверхность большинства металлов покрыта адсорбционными или фазовым. Это особенно относится к реакции выделения кислорода, которая протекает в области потенциалов 1 5 - - 2 2 В ( о. Многие металлы при чтнх потенциалах растворкютс или полностью окисляются. [1]
Кислородная реакция протекает через ряд последовательных стадий, и любая из них может определять скорость всего процесса. На каждой из этих стадий на суммарную скорость реакции влияют в общем случае разные и вполне определенные свойства электродного материала, например электронные, такие, как работа выхода электрона или характер d - зоны, энергия адсорбции промежуточных частиц реакции, геометрия атомов на поверхности и, возможно, концентрация некоторых поверхностных дефектов. [2]
Для кислородных реакций более часто, чем для водородных наблюдается определенная связь каталитической активности с типом проводимости катализатора: р-полупроводники чаще бывают активнее га-полупроводников. Это, вероятно, связано с тем, что образование ионов кислорода О -, О2 или 0 с участием электрона протекает легко и не требует большой энергии активации. Другая альтернатива - что эти ионы не участвуют в реакциях глубокого окисления. Связь каталитической активности с типом проводимости, впрочем, не во всех реакциях окисления одинакова. [3]
По этой методике удается определить критерии механизма кислородной реакции. Одна относится к предельно низким ( низкие перенапряжения), другая к предельно высоким заполнениям поверхности ( высокие перенапряжения) промежуточными частицами. [4]
Таким образом, факт снижения активности платины в кислородной реакции при ее раздроблении до размеров менее 15 А на углеродном носителе является весьма достоверным. Эффект ускорения водородной реакции при переходе к очень мелким частицам платины менее достоверен, так как не подтверждается результатами работ на высокодисперсных углеродных носителях. Возможно, однако, дальнейшие исследования устранят это противоречие, когда более глубоко будет понято влияние типа углеродного носителя на электронные свойства промотора. [5]
Среди сложных оксидных систем, электрокаталитически активных в кислородной реакции, можно выделить две группы. При комнатной температуре активность литированного оксида никеля и пе-ровскитов мала, а шпинельные катализаторы уже проявляют промотирующее действие. Кроме того, последние могут быть синтезированы при более низких температурах по сравнению с другими оксидами. [6]
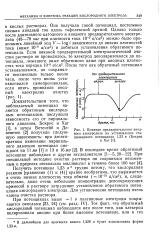 |
Влияние предварительного анодного электролиза на установление стационарного потенциала 1 23 в ( Бокрис - и Хаг. [7] |
Получить потенциал 1 23 в трудно потому, что кислородная реакция [ уравнения ( 1) и ( 4) ] крайне необратима, что выражается в очень низких плотностях тока обмена ( - 10 - 10 а / см2), и, следовательно, даже очень небольшие концентрации деполяризующих примесей в растворе затрудняют установление обратимого потенциала кислородного электрода. [8]
В области стационарных потенциалов в растворах, насыщенных кислородом, в какой-то степени должна протекать кислородная реакция и тогда, если допустить, что одновременно протекает реакция с окислом, на электроде должен устанавливаться смешанный потенциал, который будет смещен относительно потенциала окисла. Остаточные органические примеси в растворе могут быть одним из компонентов ( анодным), участвующим в установлении смешанного потенциала. Поэтому к интерпретации наблюдаемых стационарных потенциалов как потенциалов окислов следует относиться с осторожностью. [9]
Наиболее важной реакцией, для ускорения которой разрабатывались углеродные материалы, промотированные оксидами, является кислородная реакция. [10]
Если на электроде будет адсорбироваться не одна, а несколько промежуточных частиц, как это происходит в случае кислородных реакций, то теплота адсорбции одной частицы будет зависеть от присутствия ( или заполнения) всех промежуточных частиц. [11]
Следует, однако, отметить, что ни в одной из перечисленных выше работ не удалось реализовать условий, обеспечивающих протекание кислородной реакции в области потенциалов, близких к равновесному. [12]
По мере форсирования дутья и соответственно роста температур в зоне сгорания значительно интенсифицируется процесс восстановления углекислого газа, частично захватывающий даже область кислородных реакций. [13]
Наличие значительного перенапряжения между анодной и катодной составляющими реакции и возможность их протекания по различным путям являются причиной того, что в литературе отсутствуют работы, в которых обе составляющие кислородной реакции были бы исследованы в одних условиях на тех же самых электродах. Поэтому в отличие от хлорной реакции анодный процесс выделения кислорода и катодный процесс его восстановления будут рассмотрены отдельно. [14]
Однако кинетика кислородной реакции в водных растворах может значительно измениться, если обычную воду заменить тяжелой. [15]
Страницы: 1 2