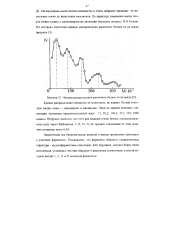
Биохимическая реакция
Cтраница 2
Многие важные биохимические реакции протекают in vivo в условиях, которые не позволяют измерить действительные концентрации компонентов. Знак величины ДО0 определяет преимущественное направление изменения стандартной свободной энергии, а ее абсолютное значение позволяет судить о том, является ли эта реакция высоко - или низкоэнергетической. [16]
Скорость биохимических реакций определяется активностью ферментов. Активность ферментов зависит от температуры, рН и присутствия в сточной воде различных веществ. С повышением температуры скорость ферментативных процессов повышается, но до определенного предела. Для каждого фермента имеется оптимальная температура, выше которой скорость реакции падает. [17]
Стереоспецифичность биохимических реакций обусловлена тем, что во всех случаях они катализируются ферментами - большими белковыми молекулами со многими асимметрическими центрами, обладающими вследствие этого высокой степенью асимметричности. Стереоспецифичность живых организмов имеет решающее значение для эффективности их функционирования. Причина состоит в том, что практически невозможна такая конструкция организма, при которой он оказался бы в состоянии функционировать на базе всех теоретически возможных изомеров молекул, содержащих большое число асимметрических центров. Так, если в молекуле белка имеется 100 различных асимметрических центров ( это вполне обычное и даже не слишком большое число), то должно существовать 2100 или 1030 возможных оптических изомеров. Организм, построенный таким образом, чтобы оказаться в состоянии функционировать, используя каждый из этих изомеров, должен был бы, как нетрудно видеть, иметь большие размеры. [18]
Стереоспецифичность биохимических реакций обусловлена тем, что во всех случаях они катализируются ферментами - большими белковыми молекулами со многими асимметрическими центрами, обладающими вследствие этого высокой степенью асимметричности. Стереоспецифичность живых организмов имеет решающее значение для эффективности их функционирования. Причина состоит в том, что практически невозможна такая конструкция организма, при которой он оказался бы в состоянии функционировать на базе всех теоретически возможных изомеров молекул, содержащих большее число асимметрических центров. Так, если в молекуле белка имеется 100 различных асимметрических центров ( это вполне обычное и даже не слишком большое число), то должно существовать 2100 или Ш30 возиэж-ных оптических изомеров. [19]
Стереоспецифичность биохимических реакций обусловлена тем, что во всех случаях они катализируются ферментами - большими белковыми молекулами со многими асимметрическими центрами, обладающими вследствие этого высокой степенью асимметричности. Стереоспецифичность живых организмов имеет решающее значение для эффективности их функционирования. Причина состоит в том, что практически невозможна такая конструкция организма, при которой он оказался бы в состоянии функционировать на базе всех теоретически возможных изомеров молекул, содержащих большое число асимметрических центров. Так, если в молекуле белка имеется 100 различных асимметрических центров ( это вполне обычное и даже не слишком большое число), то должно существовать 2100 или 1030 возможных оптических изомеров. Организм, построенный таким образом, ятобы оказаться в состоянии функционировать, используя каждый из этих изомеров, должен был бы, как нетрудно видеть, иметь большие размеры. [20]
Катализ биохимических реакций, протекающих в живых организмах, осуществляется ферментами. Довольно часто коферменты структурно идентичны пли структурно подобны одному из витаминов, которые используются организмом для построения ферментов. [21]
Скорость биохимических реакций определяется активностью ферментов, которая зависит от температуры, рН и присутствия в сточной воде различных веществ. С повышением температуры скорость ферментативных процессов повышается, но до определенного предела. Для каждого фермента имеется оптимальная температура, выше которой скорость реакции падает. [22]
Скорость биохимических реакций определяется активностью ферментов, которая зависит от температуры, рН и присутствия в сточной воде различных веществ. Для каждого фермента имеется оптимальная температура, выше которой скорость реакции падает. Для разрушения сложной смеси органических веществ необходимо 80 - 100 различных ферментов. [23]
Среди различных биохимических реакций, протекающих с участием фосфопиридоксалевых ферментов, особый интерес представляют еще два типа превращений - декарбоксилирова ие аминокислот и расщепление триптофана. [24]
При биохимических реакциях, например при спиртовом брожении, богатая атомами кислорода молекула сахара, в результате межмолекулярного и внутримолекулярного окисления-восстановления, превращается в спирт, угольную кислоту и отчасти в глицерин. [25]
Ферменты катализируют биохимические реакции стереоспеци-фично. Вследствие этого асимметрический синтез в природе происходит повсеместно и чаще всего в единственном направлении. Следовательно, большинство природных соединений оптически активно, потому что получены при каталитическом действии ферментов, обладающих определенной трехмерной структурой. В самом общем, виде можно сказать, что между субстратом и активным центром фермента существует точное геометрическое соответствие. [26]
Практически все биохимические реакции в живых организмах протекают с участием ферментов. Установлено, что ферменты образуют упорядоченные структуры - мультиферментные комплексы. [28]
Практически все биохимические реакции катализируются особыми веществами - ферментами, которые представляют собой белки, в ряде случаев связанные с неорганическими ионами или небольшими органическими молекулами. В основном каждая реакция катализируется особым ферментом, так что существует почти столько же типов катализаторов, сколько биохимических реакций. Одни группы ферментов катализируют различные реакции окисления, другие - реакции гидролиза, третьи - образование связи С-С и др. Таким образом, по своему детальному механизму каждая катализируемая ферментом реакция представляет особый случай, причем трудности в исследовании таких реакций связаны с необычной величиной и сложностью молекулы катализатора. Несмотря на это основные принципы действия ферментов можно легко понять с позиций теории скоростей реакции. [29]
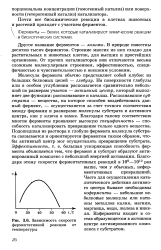 |
Зависимость скорости став образующегося в активном. [30] |
Страницы: 1 2 3 4