Цепная разветвленная реакция
Cтраница 3
Однако в отличие от быстрых цепных разветвленных реакций, заканчивающихся воспламенением, при медленном окислении углеводородов разветвления цепи происходят весьма редко, они как бы запаздывают по отношению ко времени развития основной цепи реакции окисления. Тем самым автоускорение процесса оказывается растянутым во времени. Подобный механизм делается возможным потому, что разветвления цепи при окислении углеводородов связаны с редкими процессами образования свободных радикалов за счет реакций промежуточных веществ молекулярного характера. [31]
Таким образом, теория цепных неразветвленных и цепных разветвленных реакций, в которых скорость реакции обрыва цепи пропорциональна первой степени концентрации активных центров, не позволяет объяснить отмеченное нами явление двоякого действия добавок ингибитора. Наряду с этим представление о макроскопических стадиях и особой роли начального периода позволяет понять это своеобразное явление. [32]
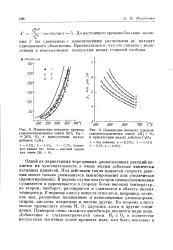 |
Понижение верхнего предела самовоспламенения смеси 80 % Й2 20 % Оа в присутствии малых добавок СаНе.| Повышение нижнего предела самовоспламенения смеси 2Щ Ог в присутствии малых добавок СаНе. [33] |
Одной из характерных черт цепных разветвленных реакции является их чувствительность к очень малым добавкам химически активных примесей. В первом случае полуостров самовоспламенения суживается и перемещается в сторону более высоких температур, во втором, наоборот, расширяется и сдвигается в область низких: температур. К первому классу веществ относятся, например, такие, как иод, различные насыщенные и ненасыщенные углеводороды, спирты, кислоты, альдегиды и многие другие. [34]
Модель 6 представляет особый вид цепной разветвленной реакции, в которой разветвление цепей происходит по реакции радикала с промежуточным продуктом Р и приводит к образованию трех радикалов. Если обрыв цепей преобладает над их разветвлением в ходе всей реакции ( ke kai [ P ] p), то процесс имеет стационарный характер. [35]
Как известно, существует класс цепных разветвленных реакций - рассказывает соавтор открытия А. М. Чайкин - которые характеризуются тем, что при взаимодействии активной частицы с исходным веществом наряду с продуктом реакции образуется более чем одна новая активная частица. В этом случае в ходе реакции число активных частиц непрерывно увеличивается, что приводит к резкому возрастанию ее скорости. Такая реакция может завершиться самовоспламенением и даже взрывом. [36]
Модель 6 представляет особый вид цепной разветвленной реакции, в которой разветвление цепей происходит по реакции радикала с промежуточным продуктом Р и приводит к образованию трех радикалов. Если обрыв цепей преобладает над их разветвлением в ходе всей реакции ( ke k3i [ Р ] р), то процесс имеет стационарный характер. [37]
Как уже указывалось, в цепных разветвленных реакциях изменение концентрации свободных радикалов п в зависимости от соотношения между скоростью разветвления fit и скоростью обрыва цепей gn может описываться двумя различными законами. При / g ( q / - fi 0) в соответствии с (VII.47) устанавливается стационарная концентрация свободных радикалов и реакция идет с постоянной скоростью, которая в ряде случаев оказывается неизмеримо малой. При / g ( Ф 0) в соответствии с ( VI 1.48) свободные радикалы накапливаются по экспоненциальному закону, скорость реакции также возрастает экспоненциально и происходит цепное воспламенение реакционной смеси. [38]
Как уже указывалось, в цепных разветвленных реакциях изменение концентрации свободных радикалов п в зависимости от соотношения между скоростью разветвления fn и скоростью обрыва цепей gn может описываться двумя различными законами. При / g ( ф / - g 0) в соответствии с ( VI 1.47) устанавливается стационарная концентрация свободных радикалов и реакция идет с постоянной скоростью, которая в ряде случаев оказывается неизмеримо малой. При fg ( ф 0) в соответствии с ( VI 1.48) свободные радикалы накапливаются по экспоненциальному закону, скорость реакции также возрастает экспоненциально и происходит цепное воспламенение реакционной смеси. [39]
Следует отметить, что так как цепные разветвленные реакции протекают не по стационарному режиму, то при выводе кинетических соотношений неправомерно принимать концентрацию свободных радикалов стационарной. Однако при этом получаются очень сложными соотношения. По этому методу концентрации всех свободных радикалов условно принимаются постоянными, кроме радикала, концентрация которого в реакции самая значительная и по которому выводится основное кинетическое соотношение. Согласно этому методу и были получены приведенные выше соотношения. [40]
Реакция окисления сероводорода относится к классу цепных разветвленных реакций. Однако в литературе было описано аналогичное явление и для реакции, относящейся к классу цепных неразветвленных реакций. Было показано, что термический распад этана тормозится добавками пропилена, если последний присутствует в исходной реагирующей смеси. [41]
На рис. 64 приведена зависимость скорости цепной разветвленной реакции от времени, а на рис. 65 - зависимость скорости протекания реакции при различных ф, постоянных по времени. [42]
Уже на ранних стадиях периода индукции устанавливается цепная разветвленная реакция. Несомненно, что и на более поздних стадиях кинетика реакции определяется промежуточными реагентами. Концентрации промежуточных частиц и скорости реакций с их участием достигают максимальных значений, а затем уменьшаются. Реакции, имеющие порядок по концентрации активных частиц и продуктов выше первого, постепенно начинают конкурировать с реакциями между активным центром и исходным веществом. [43]
Существование вырожденных разветвлений и обусловленных ими свойств медленных цепных разветвленных реакций представляет собой весьма благодарную основу для развития новых принципов управляемого ( регулируемого) осуществления реакций окисления. Наряду с наличием вырожденных разветвлений реакции окисления углево 1Ьрдов характеризуются и многими другими усложнениями классическЩ хемы развития цепного процесса. К этим усложнениям прежде всего относятся явления макроскопической стадийности при окислении углеводородов и, особенно, наличие разделяющихся во времени макроскопических стадий. [44]
Свыше трех десятилетий отделяют нас от открытия Н. Н. Семеновым цепных разветвленных реакций, открытия, стимулировавшего изучение цепных реакций во всем мире и сделавшего эти исследования одним из главных направлений химической физики. За это время выполнено огромное количество работ по теоретическому и экспериментальному изучению кинетики и механизма цепных реакций, открытию новых признаков, свойств и особенностей цепных процессов, установлению природы активных центров, их идентификации и элементарным реакциям. [45]
Страницы: 1 2 3 4