Необратимая реакция
Cтраница 3
Примером необратимых реакций, протекающих с образованием слабого электролита - воды, являются реакции нейтрализации, протекающие между кислотами и основаниями. [31]
Для необратимых реакций концентрация CaL компонента А в объеме жидкой фазы равна нулю; для обратимых реакций величину Са L следует определять, исходя из материального баланса и константы химического равновесия. Константа закона Генри ( Н р / С) равна константе для чистого растворителя, исправленной с учетом снижения растворимости вследствие присутствия примесей; поправочный коэффициент определяется эмпирически и его влияние весьма невелико. Поправку на присутствие реагента В делать не следует, так как это вещество обычно отсутствует на поверхности раздела фаз. Если бы диффузия вещества В через всю толщу жидкостной пленки происходила без взаимодействия с реагентом А, это означало бы, что определяющей является скорость диффузии через пограничную газовую пленку. [32]
Для необратимых реакций, как показано на рис. У1П - 4, макси-мально возможная степень превращения не зависит от температуры. Следовательно, максимальная; производительность достигается при максимально возможной температуре проведения процесса. Эта оптимальная температура определяется конструктивными материалами, из которых изготовлен реактор, или условиями протекания побочных реакций. [33]
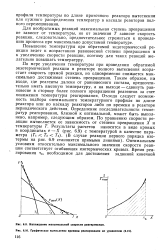 |
Графическое вычисление времени реагирования по уравнению. [34] |
Для необратимых реакций максимальная степень превращения не зависит от температуры, но от значения Т зависит скорость реакции, следовательно, предпочтительнее стремиться к проведению процесса при максимально допустимой температуре. [35]
Для необратимых реакций лимитирующим может быть только одно из исходных веществ. При протекании необратимой реакции в диффузионной области концентрация лимитирующего вещества у поверхности равна нулю, концентрации остальных веществ определяются из условия стехиометрии потоков. При протекании обратимой реакции в диффузионной области концентрации всех веществ определяются химическим равновесием на поверхности и лимитирующим может быть как исходное вещество, так и продукт реакции. [36]
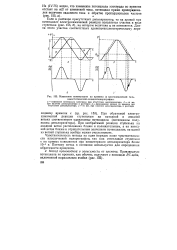 |
Изменение потенциалов во времени в многоцикличной гальваностатической осциллополярографии. [37] |
При необратимой реакции ступенька на анодной ветви расположена ближе к положительным, а а катодной ветви ближе к отрицательным значениям потенциалов; на одной из ветвей ступенька вообще может отсутствовать. [38]
У необратимых реакций обратный процесс выражен весьма незначительно. Обычно к ним относят те реакции, при протекании которых: 1) один из образующихся продуктов уходит из сферы реакции - выпадает в виде осадка, выделяется в виде газа; 2) образуется малодиссоциированное соединение; 3) реакция сопровождается большим выделением энергии. [39]
У необратимых реакций обратный процесс выражен весьма незначительно. [40]
Для необратимой реакции уравнения (7.6) или (7.10), которые не зависят от режима работы электрода, остаются справедливыми. [41]
Среди практически необратимых реакций можно выделить несколько типов. [42]
Для практически необратимых реакций во всем интервале их протекания выполняется неравенство (VII.47) и влияние обратной реакции не должно учитываться. Как видно, значение у при данном составе реакционной смеси определяет необходимость ( или отсутствие ее) учета влияния обратной реакции и является критерием возможности пренебрежения этим влиянием. [43]
Для необратимых реакций поликонденсации справедливы приведенные выше общие закономерности поликонденсации в растворе. Однако проведение быстрых необратимых реакций при поликонденсации в растворе имеет ряд особенностей. [44]
Для практически необратимых реакций изотермический процесс также далеко не всегда является наиболее выгодным. [45]
Страницы: 1 2 3 4