Необратимая реакция - первый порядок
Cтраница 2
В реакторе вытеснения проводится необратимая реакция первого порядка А - R. Плотность реакционной смеси постоянна. В исходной смеси продукт отсутствует. [16]
Тепло выделяется в результате необратимой реакции первого порядка. [17]
Это выражение характеризует кинетику необратимой реакции первого порядка. [18]
 |
Концентрация исходных и конечных веществ для параллельных реакций первого порядка. [19] |
Это уравнение аналогично уравнению необратимой реакции первого порядка. [20]
 |
Кинетические кривые. [21] |
При м с р 2.5. Жчдксфазная необратимая реакция первого порядка протекает без изменения плотности реагирующих веществ в реакторе периодического действия. Продукты реакции в исходном сырье отсутствуют. [22]
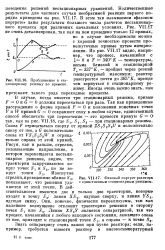 |
Приближение к стационарному режиму во времени.| Фазовый портрет реактора с единственным стационарным режимом. [23] |
Количественные результаты для частного случая необратимой реакции первого порядка приведены на рис. VI 1.17. В этом так называемом фазовом; портрете даны результаты большого числа расчетов нестационарного процесса при различных начальных условиях. [24]
Для интегрального реактора в случае необратимой реакции первого порядка коэффициент эффективности может быть вычислен способами, использованными выше ( см. стр. [25]
Это уравнение отличается от уравнения необратимых реакций первого порядка [ уравнение ( 4) ] тем, что вместо начальной концентрации а реагента А фигурирует равновесная концентрация хе этого реагента, а также тем, что вместо константы скорости необратимой реакции фигурирует сумма констант обеих реакций, составляющих обратимую реакцию. [26]
Можно ли определить константу ifei параллельной необратимой реакции первого порядка, измеряя только текущие концентрации веществ А и В. [27]
Концентрационные профили, возникающие при необратимых реакциях первого порядка, преобразуются в полулогарифмической системе координат ( In q, x) к линейному виду. Согласно немногочисленным имеющимся данным такие концентрационные профили химических элементов в рудных телах и их первичных ореолах являются наиболее типичными. По всей вероятности, это связано с тем, что большинство рудообразующих процессов являются необратимыми и эффективно протекающими по первому порядку. Реакции более высоких порядков менее вероятны. [28]
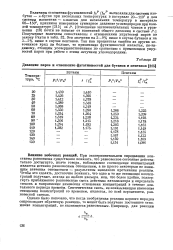 |
Давление паров и отношение фугативностей для бутанов и пентанов. [29] |
Однако было показано, что когда необратимая реакция первого порядка сопровождает обратимую реакцию, то может быть получено постоянное отношение концентраций, не являющееся равновесным. [30]
Страницы: 1 2 3 4