Анодная реакция - ионизация - металл
Cтраница 1
Анодная реакция ионизации металла ( 5) и катодная реакция ассимиляции электронов ( 6) являются первичными коррозионными реакциями, а их продукты ( Ме - т Н2О и D - ne) - первичными продуктами коррозии. [1]
Анодные реакции ионизации металла протекают преимущественно в порах ( капиллярах) покрытия, но вследствие изменений концентрации ( быстрое насыщение электролита в капиллярах собственными ионами металла) процесс перехода металла в пассивное состояние облегчается. Некоторые исследователи полагают, что адгезионная связь покрытия с металлом также тормозит переход атомов металла в ионное состояние. [2]
 |
Потеря массы трубной стали в зависимости от ее температуры. [3] |
Сосредоточение анодной реакции ионизации металла на отдельном участке поверхности особенно опасно, для трубопроводов, так как коррозионный процесс протекает с большой скоростью, разрушения обнаруживаются внезапно и, как правило, являются причиной аварий. На рис. 8 представлены наиболее характерные виды разрушений трубопроводов. [4]
Исследование анодной реакции ионизации металла ( рис. 5 15) показало, что малые добавки хотя и смещают потенциал в положительную сторону, однако поляризуемость электрода меняется мало. Все это указывает на то, что сдвиг потенциала в положительную сторону обусловлен, очевидно, в основном изменением кинетики катодного процесса. Большие концентрации ингибитора ( 1 - 2 г / л) способствуют сильной анодной поляризации электрода, что связано со специфической адсорбцией ингибитора и упрочнением химической связи по мере смещения потенциала в положительную сторону. [5]
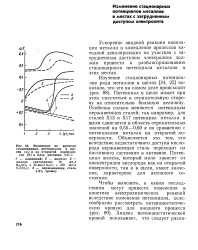 |
Изменение во времени стационарных потенциалов в щс - ( а и на открытой поверхно - ( б в 0 5. [6] |
Ускорение анодной реакции ионизации металла и замедление процессов катодной деполяризации на участках с затрудненным доступом электролита должно привести к разблагораживанию стационарного потенциала металлов в этих местах. [7]
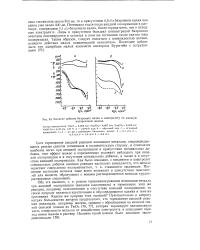 |
Влияние добавок бихромата калия к электролиту на анодную поляризацию железа. [8] |
Хотя торможение анодной реакции ионизации металлов, сопровождающееся резким сдвигом потенциала в положительную сторону, и отмечается наиболее четко при анодной поляризации в присутствии специальных добавок, этот эффект можно в определенных условиях наблюдать при анодной поляризации и в отсутствие специальных добавок, а также и в отсутствие внешней поляризации. Пассивное состояние металла чаще всего возникает в присутствии окислителей или веществ, образующих с ионами растворяющегося металла труднорастворимые соединения. [9]
Очень большая замедленность анодной реакции ионизации металла имеет место при возникновении анодной пассивности ( см. с. Значение этого вида анодной поляризации рассчитать нельзя и его берут обычно из опытных данных. [10]
Как видно, ускорение анодной реакции ионизации металла сероводородом аналогично действию ОН -, так как в обоих случаях на поверхности металла возникает катализатор. [11]
Влияние сернистого газа на течение анодной реакции ионизации металла, как было показано выше, по крайней мере для видимых пленок, не является столь значительным, как на течение катодной реакции. Однако новые продукты катодной реакции, возникающие за счет восстановления сернистой кислоты, могут привести к изменению состава образующихся продуктов коррозии. Так, например, образующийся при восстановлении сернистого ангидрида ион тиосульфата может в кислой среде распадаться с образованием двухвалентного иона S2 -, который легко вступает в реакцию с металлом, образуя сульфиды. Качественный анализ продуктов коррозии на меди проведенный нами при помощи азида натрия, обнаружил наличие сульфида. [12]
 |
Зависимость тока коррозии железа ( iKOp от концентрации NO. [13] |
ОН-адс, которые участвуют в анодной реакции ионизации металла ( 15) и тем самым стимулируют его растворение. [14]
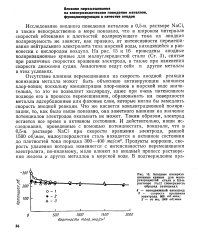 |
Анодные поляриза ционные кривые для малоуглеродистой стали в 0 5 - н. растворе NaCl ( поверхность. [15] |
Страницы: 1 2 3 4