Анодная реакция - ионизация - металл
Cтраница 2
Отсутствие влияния перемешивания на скорость анодной реакции ионизации металла может быть объяснено активирующим влиянием хлор-ионов; поскольку концентрация хлор-ионов в морской воде значительна, то это не позволяет кислороду, даже при очень интенсивном подводе его в процессе перемешивания, образовывать на поверхности металла адсорбционные или фазовые слои, которые могли бы замедлить скорость анодной реакции. Что же касается концентрационной поляризации, то, как было выше показано, она заметного влияния на значение потенциалов электродов оказывать не может. Таким образом, электрод остается все время в активном состоянии. Продукты коррозии, скорость удаления которых изменяется с интенсивностью перемешивания электролита, по-видимому, мало влияют на анодный процесс растворения железа и других металлов в морской воде. [16]
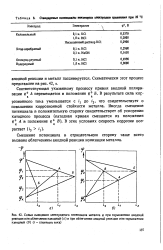
 |
Катодные поляризационные кривые для. [17] |
Влияние сернистого газа на скорость анодной реакции ионизации металла, по крайней мере, для видимых пленок электролитов значительно меньше, чем на катодную реакцию. [18]
Окисление металла в электролитах называют анодной реакцией ионизации металла, а обратную - катодной реакцией восстановления. Важно, что в процессах переноса массы и электрических зарядов через границу раздела металл - электролит при равновесном ( обратимом) состоянии происходит полный баланс переноса как по массе, так и по зарядам. [19]
Обычно локальная коррозия является следствием сосредоточения анодной реакции ионизации металлов на отдельных небольших участках поверхности металла, в то время как на остальной части поверхности протекают преимущественно катодные реакции. [20]
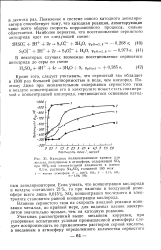
 |
Зависимость коррозии малоуглеродистой стали от высоты расположения металла над уровнем моря.| Зависимость скорости коррозии. [21] |
По мере утоньшения слоя электролита коррозия падает вследствие торможения анодной реакции ионизации металла. С увеличением толщины за пределы максимуме коррозия падает в результате у меныпения скорости катодной реакции восстановления кислорода. [22]
Смешение потенциала в отрицательную сторону чаще всего вызвано облегчением анодной реакции ионизации металла. [24]
 |
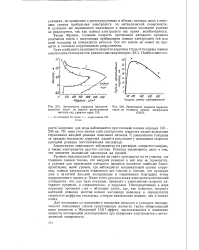
Схема, поясняющая причины измене. [25] |
Смещение потенциала в отрицательную сторону чаще всего обусловлено облегчением анодной реакции ионизации металла. [26]
 |
Определение скорости саморастворения по кривым поляризации. [27] |
Многочисленные наблюдения за процессами разрушения металлов и сплавов показывают, что анодная реакция ионизации металла ( растворение) происходит на ограниченном количестве участков, причем часто наблюдается их удивительное постоянство. Последнее объясняется тем, что коррозия, начавшаяся на каком-либо слабом участке, сильно уменьшает вероятность возникновения процесса на других участках. [28]
Пассивность - это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов. [29]
Пассивность - это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов. Металл, находящийся в пассивном состоянии, практически не корродирует, несмотря на то что его потенциал значительно ( на сотни милливольт) смещен в положительную сторону от стационарного значения. Вместо увеличения скорости наблюдается торможение анодного процесса. [30]
Страницы: 1 2 3 4